Задержание последа у коров: причины, симптомы, лечение и диагностика
После рождения плода у коровы послед, как правило, отделяется в течение 12 часов. Если послед не отделился за это время, необходимо обязательно принять ветеринарные меры. Отсутствие своевременной помощи грозит бактериальным заражением половых органов и организма в целом, хроническим эндометритом, бесплодием.
Почему происходит задержание поcледа?
Послед может полностью или частично задерживаться в родовых путях коровы. Это могут быть плодные оболочки целиком или отдельные плаценты. Эта акушерская патология встречается в среднем у 14,8% коров. Заболевание чревато различными осложнениями (снижение продуктивности, потеря способности воспроизводить потомство), которые при отсутствии своевременной помощи фиксируют у 54–75% особей.
К основным причинам задержания последа у животных относят:
-
атонию и гипотонию матки (слишком слабые схватки после родов или их отсутствие) из-за нарушения обмена веществ;
-
патологические нарушения в эндометрии, хорионе, в результате чего плаценты матери и теленка сращиваются;
-
различная инфекция (бруцеллез, вибриоз), которая приводит к повышению тургора карункулов;
-
патологически тяжелые роды с чрезмерным растяжением матки.

Среди факторов риска — погрешности в кормлении (в частности, недостаток кальция) в период стельности, отсутствие достаточного моциона (прогулок), нарушения санитарного режима.
Как определить проблему?
Заметить остатки последа довольно просто — чаще всего красные, серо-красные бугристые плодные оболочки свисают из детородных органов коровы иногда вплоть до скакательных суставов. Либо же послед можно заметить в полости матки при исследовании родовых путей. Чтобы установить проблему, необходимо тщательно осматривать особь в первые часы после родов. Для диагностики проводят пальпацию матки, влагалища, исследуют выделившуюся плаценту.
Симптомы задержания последа
Если задержание все же произошло, но осмотр животного не был произведен своевременно, ветеринара должны насторожить следующие симптомы, которые проявляются в течение суток:
-
корова выгибает спину и тужится, как при мочеиспускании;
-
выглядит угнетенной, отказывается от корма;
-
у животного повышается температура;
-
молочная продуктивность резко падает.

Если послед остается в полости матки, но не был своевременно обнаружен, уже на вторые сутки его масса под воздействием бактерий начинает разлагаться с характерным неприятным запахом. Чаще всего возникает эндометрит, вагинит, мастит. Дальнейшее развитие инфекции в организме чревато сепсисом.
Лечение задержания последа у коровы
Для решения проблемы необходимо стимулировать сокращение матки — это позволит последу отделиться. Также нужно защитить организм животного от развития инфекции. В ветеринарии существует множество рекомендаций для данного клинического случая, однако далеко не все они доказали эффективность на практике. NITA-FARM представляет препараты последнего поколения, которые успешно прошли испытания и рекомендованы ведущими ветеринарами РФ для профилактики и лечения задержания последа у коровы. Наши специалисты предлагают применять одно из указанных ниже средств.
-
«Утеротон».
 В основе этого негормонального препарата — пропранолола гидрохлорид, действие которого направлено на усиление сокращений гладкой мускулатуры матки. Для профилактики задержания последа Утеротон вводят при родах, однократно внутримышечно или внутривенно в дозе 10мл на животное. При обнаружении симптомов задержания последа необходимо внутримышечно или внутривенно ввести лекарство: 3 раза по 10 мл с 12-часовым интервалом. Функциональная активность матки повышается в 2,5–3,3 раза. Плодные оболочки, как правило, отходят в течение 1–4 часов.
В основе этого негормонального препарата — пропранолола гидрохлорид, действие которого направлено на усиление сокращений гладкой мускулатуры матки. Для профилактики задержания последа Утеротон вводят при родах, однократно внутримышечно или внутривенно в дозе 10мл на животное. При обнаружении симптомов задержания последа необходимо внутримышечно или внутривенно ввести лекарство: 3 раза по 10 мл с 12-часовым интервалом. Функциональная активность матки повышается в 2,5–3,3 раза. Плодные оболочки, как правило, отходят в течение 1–4 часов.
-
«Сепранол». Препарат доказал свою эффективность как средство для профилактики эндометритов. В его основе — хлоргексидин, пропранолол. В составе отсутствуют антибиотики, гормоны. Действующие вещества активно уничтожают патогенную флору и стимулируют активность матки. После завершения выведения плода вводят внутриматочно 2 таблетки препарата однократно. При необходимости повторяют введение через сутки.

-
«Лексофлон». В случае задержания последа с целью уничтожения патогенной микрофлоры в матке, рекомендуется введения антибиотика Лексофлон. В основе этого препарата – левофлоксацин 15%. Вводят в дозе 1мл/30 кг массы тела внутримышечно 3-5 дней подряд.
Информация в данной статье носит рекомендательный характер. Перед применением препарата необходима консультация ветеринарного врача.
Задержание последа (retentio placentae, s. retentio secundinarum)
Патология третьей стадии родового акта, проявляющаяся нарушением отделения или выведения из родовых путей последа. О задержании последа говорят в том случае, если послед не отделяется у коров через 6-10 ч, у кобыл через 35 мин, у овец и коз через 5 ч, у свиней, сук, кошек и крольчих через 3 ч после рождения плодов. Задержание последа может быть у животных всех видов, но чаще наблюдается у коров, что объясняется своеобразием структуры плаценты и взаимосвязи между ее плодной и материнской частями.
Этиология. Непосредственными причинами задержания последа являются недостаточная сократительная способность (гипотония) или полное отсутствие сокращений (атония) матки, сращения (спайки) маточной и плодной частей плацент вследствие патологических процессов в них.
Симптомы и течение. У коров чаще отмечают неполное задержание последа. Из наружных половых органов выступает значительная часть плодных оболочек, свисающих до скакательных суставов. Коровы стоят с вытянутой спиной, натуживаются, часто принимают позу, характерную для мочеиспускания.
При полном задержании последа распад тканей плаценты несколько задерживается и при несвоевременном диагнозе на четвертый-пятый день из матки начинается выделение катарально-гнойного экссудата с примесью крошек фибрина. Одновременно изменяется общее состояние коров.
Осложнениями задержания последа у коров могут быть эндометрит, вагинит, послеродовая инфекция, маститы.
У кобыл задержание последа сопровождается тяжелым общим состоянием. Уже в первые сутки отмечают общее угнетение, повышение температуры тела, учащение пульса и дыхания, отсутствие аппетита. Животное стонет, тужится, выделения из матки темно-красного цвета, неприятного гнилостного запаха. При сильном натуживании возможно выпадение матки. Если своевременно не оказано лечение, то признаки ухудшения общего состояния у животного быстро нарастают, развивается септицемия со смертельным исходом в течение первых двух-трех дней.
У овец и коз задержание последа встречается очень редко, но у коз, как и у свиней, часто осложняется септикопиемией. Иногда развивается газовая флегмона, а также столбняк.
У свиней при задержании последа отмечают беспокойство, легкие потуги. Нарушается рефлекс молокоотдачи. Развивается катаральное воспаление матки, которое может перейти в гнойно-катаральное. Часто вследствие хронического эндометрита животные остаются бесплодными.
Задержание последа может осложняться септикопиемией.
У собак и кошек задержание последа протекает неблагоприятно. Исход летальный в результате быстро развивающейся септицемии.
Лечение коров при задержании последа начинают через 6 — 8 часов после рождения теленка. Оно предусматривает повышение тонуса и сократительной функции матки, обеспечивающих наиболее быстрое и полное отделение последа, предупреждение инфицирования матки, развития в ней воспалительного процесса и общей послеродовой инфекции.
Коровам в первые 6-8 ч после рождения плода для стимулирования сокращения матки назначают внутрь 500-700 г сахара растворенного в 2 л воды. Выпаивают 3-5 л околоплодных вод, два-три раза через 5-6 ч, разбавив их в 5-6 л теплой подсоленной воды. Подкожно инъецируют окситоцин или питуитрин, 0,5%-ный раствор прозерина (2—3 мл), 0,1%-ный раствор карбахолина (2—3 мл) и др. В полость матки вводят препараты, предупреждающие разложение последа, метромакс или экзутер (по 2 палочки), порошок трициллина (10-5 г) или 5—10%-ную взвесь его в рыбьем жире (150-200 мл), фуразолидоновые палочки (2-3 шт. ) и др. Для нарушения связи между плацентами вливают пепсин с соляной кислотой (пепсин 20 г, соляной кислоты 15 мл, воды 300 мл). внутривенно, дважды через 12 ч вводят 20 %-ный раствор глюкозы 200-300 мл и 100—150 мл 10 %-ного раствора кальция хлорида. Назначают внутриаортально 1 %-ный раствор новокаина в дозе 100 мл с одновременным вливанием в матку 500 мл 30 %-ного раствора ихтиола.
) и др. Для нарушения связи между плацентами вливают пепсин с соляной кислотой (пепсин 20 г, соляной кислоты 15 мл, воды 300 мл). внутривенно, дважды через 12 ч вводят 20 %-ный раствор глюкозы 200-300 мл и 100—150 мл 10 %-ного раствора кальция хлорида. Назначают внутриаортально 1 %-ный раствор новокаина в дозе 100 мл с одновременным вливанием в матку 500 мл 30 %-ного раствора ихтиола.
Если консервативные приемы оказались не эффективными, через 24 часа после рождения плода прибегают к оперативному (ручному) отделению последа. После отделения последа в полость матки вводят бактерицидные палочки на пенящейся основе, а подкожно—маточные средства.
Оперативное вмешательство при сильных потугах у коровы проводят на фоне низкой сакральной анестезии (введение 10 мл 1-1,5%-ного раствора новокаина в эпидуральное пространство) или новокаиновой блокады тазового нервного сплетения по А. Д. Ноздрачеву.
У овец и коз после подкожного применения маточных препаратов скручиванием и потягиванием свисающей части последа иногда удается его удалить. У многорожавших овец и коз можно отделить послед рукой; у основания котиледон сдавливают рукой, и плодная часть выжимается из карункула. К операции прибегают через 3—5 ч после рождения плодов. По окончании операции в матку вводят бактерицидные препараты, а подкожно маточные средства.
У многорожавших овец и коз можно отделить послед рукой; у основания котиледон сдавливают рукой, и плодная часть выжимается из карункула. К операции прибегают через 3—5 ч после рождения плодов. По окончании операции в матку вводят бактерицидные препараты, а подкожно маточные средства.
У кобыл отделяют послед не позднее 2 ч после рождения жеребенка. Делают туалет наружных половых органов, хвост бинтуют и отводят в сторону. Свисающую часть последа захватывают левой рукой, а правую вводят между хорионом и слизистой оболочкой матки и осторожно вытягивают ворсины из крипт. Можно также удалить послед скручиванием и натягиванием свисающей части. Для предупреждения развития микрофлоры и разложения последа в матку вводят антимикробные эмульсии в небольших количествах (200—250 мл).
У свиней при задержании последа не позже 2-3 ч после рождения плодов стимулируют сокращения матки подкожным введением 0,5%-ного раствора прозерина (0,8-1,0 мл), питуитрина (1-2 мл.) или окситоцина (30 ЕД с интервалом в 1,5-2 ч). Из средств общей терапии назначают кофеин подкожно и раствор кальция глюконата внутримышечно или внутривенно в дозе 30—50 мл.
Из средств общей терапии назначают кофеин подкожно и раствор кальция глюконата внутримышечно или внутривенно в дозе 30—50 мл.
Профилактика задержания последа заключается в строгом соблюдении всего комплекса хозяйственных и зооветеринарных мероприятий. Особое внимание уделяют полноценному кормлению и организации моциона беременных животных, правильному ведению родов и уходу за матерью. Роженицам выпаивают 3-5 л околоплодных вод или 1-2 л молозива
Задержание последа у сельскохозяйственных животных
Из наиболее часто встречающихся осложнений в послеродовой период у коров является задержание последа. Проявляется это нарушением отделения или выведения из родовых путей плодных оболочек по истечении определённого времени после рождения плода более – 6-8 часов.Непосредственными причинами задержания последа являются недостаточная сократительная способность или полное отсутствие сокращений матки, сращения (спайки) и другие патологические процессы в половых путях.
Этому способствует одностороннее неполноценное кормление, отсутствие прогулок, длительный период доения более 300 дней, короткий период отдыха, чрезмерное растяжение матки при двойнях или тяжёлых родах.
Различают полное задержание последа, когда все плодные оболочки полностью остаются в матке, и частичное, когда в полости матки остаётся часть плаценты.
У коров чаще отмечают неполное задержание последа. Из наружных половых органов свисает значительная часть плодных оболочек. Коровы стоят с вытянутой спиной, натуживаются, часто принимают позу, как для мочеиспускания.
При полном задержании последа распад тканей плаценты несколько задерживается и при несвоевременном диагнозе на четвертый-пятый день из матки начинается выделение гнойных истечений. Одновременно изменяется общее состояние коров.
Прогноз при соответствующим лечении благоприятный, однако неоказание лечебной помощи в большинстве случаев приводит к общему сепсису организма.
Диагноз ставят по результатам внешнего осмотра, пальпации влагалища, полости матки и исследования выделившейся плодной плаценты.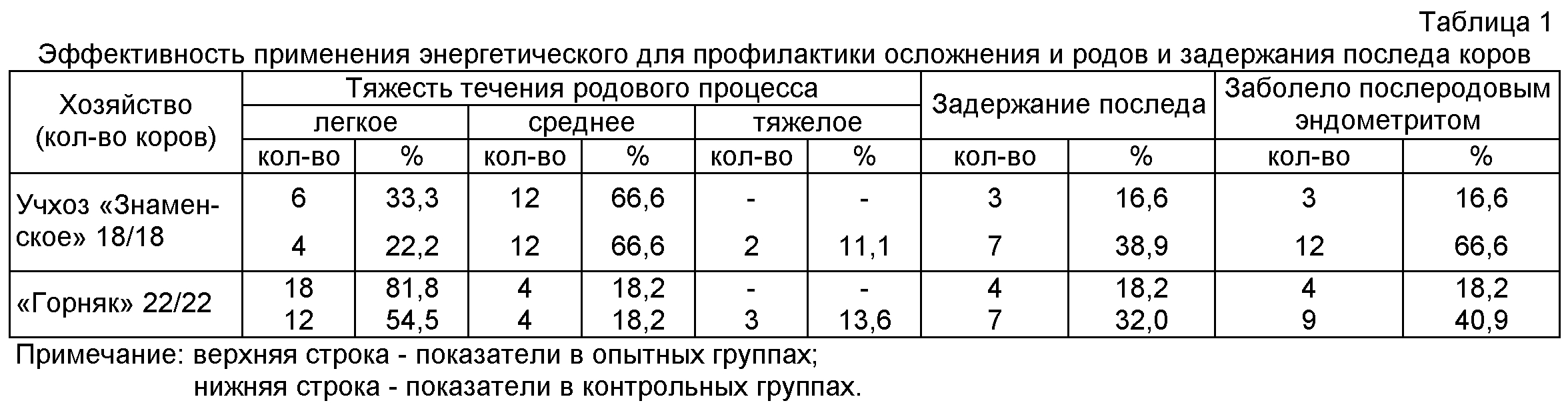
Лечение направлено на быстрое удаление задержавшихся плодных оболочек, борьбу с инфекцией, повышение тонуса матки и всего организма.
Профилактика состоит в применении комплекса зооветеринарных мероприятий во время беременности, родов и в послеродовой период. Основные из них: полноценное кормление, своевременный запуск, предоставление активного моциона, проведение родов в боксе, облизывание коровой новорождённого, дача околоплодных вод и молозива, осеменение животных в первый месяц после родов.
Задержание последа у коров: причины и лечение
У 14-22% коров после отела фиксируется задержание последа. Причины на то могут быть самые разные – нехватка минералов, ожирение или истощение, нехватка прогулок, большой размер плода, болезни и так далее. Задержание последа у коров является причиной эндометрита, субинволюции матки, гипофункции яичников, мастита, атонии матки.
Через сколько выходит послед у коров?
Если отделение последа у коров не произошло спустя четыре-шесть часов, нужно приступать к лечению. Плодные оболочки внутри животного начинают разлагаться, возникает интоксикация организма, повышается температура, возникает понос, падает удой. Таких коров можно вычислить по подтянутому животу и сильно выгнутой спине.
Плодные оболочки внутри животного начинают разлагаться, возникает интоксикация организма, повышается температура, возникает понос, падает удой. Таких коров можно вычислить по подтянутому животу и сильно выгнутой спине.
Однако не спешите делать вывод о том, что у коровы не вышел послед: вполне возможно, она сама его съела. Это не опасно для животного, и лишь изредка чревато небольшими нарушениями пищеварения.
Задержание последа у коровы: лечение
В первые сутки после того, как корова отелилась, применяют консервативные методы лечения, то есть лекарствами, без оперативного вмешательства. К оперативному вмешательству – мануальному отделению последа – приступают лишь спустя двое суток после безуспешных попыток консервативных методов, и на то есть весомые причины. При мануальном отделении последа происходит травмирование эндометрия матки, способствующее возникновению послеродового эндометрита с выделением гнойно-катарального экссудата и проникновению инфекции в кровяное русло с развитием мастита.
Итак, если не отходит послед у коровы, в первые сутки после появления теленка на свет прибегают с таким способам лечения:
— дважды-трижды в сутки с интервалом пять-шесть часов корове выпаивают два-три литра молозива, разбавленных таким же количеством воды, с добавлением 30-40 грамм хлорида натрия.
— введение внутривенно 100-150 миллилитров 10% р-ра хлорида или глюконата кальция, а также 200-300 миллилитров 40% р-ра глюкозы и 15-20 ЕД окситоцина для повышения тонуса и усиления сокращений гладкой маточной мускулатуры.
— введение внутривенно 150 миллилитров хлорида кальция 10% с 200-300 миллилитрами 1% р-ра метиленового синего на сорокапроцентном растворе глюкозы.
Если осложнений не возникнет, в течение суток, а то и нескольких часов, послед у коровы должен выйти. Если этого не произошло – спустя сутки после лечения вышеупомянутыми препаратами приступают к следующим схемам лечения:
— введение внутриматочно 300-500 миллилитров 30% р-ра ихтиола и орально 100-150 миллилитров 1% р-ра новокаина на десятипроцентном растворе глюкозы, а также введение 40-60 ЕД окситоцина.
— Введение внутриматочно раствора стрептомицина и пенициллина.
После того, как послед выйдет, следует на протяжении двух-трех дней вводить в полость матки маточные пенообразующие таблетки (например «Пенофур» или «Йодопен»).
Но если и это не помогло, и через 48 часов у коровы не отходит послед – что делать, придется прибегать к оперативному вмешательству. Но не раньше – мануальное отделение последа у коровы целесообразно проводить спустя 2 суток после отела еще и потому, что из-за некроза между материнской и плодовой частью плаценты послед отделяется полностью и довольно легко, а шейка матки частично закрыта, что предупреждает проникновение микроорганизмов извне.
Не отходит послед у коровы: немного практики
На ферме ООО АФ «Лан», что на Сумщине, животных лечили медикаментозно через 12 часов поле отела. Свисающую часть последа максимально подтягивали наружу и отсекали. В первые сутки применяли внутримышечно пять свечей пробиотика «Супозит плюс» между плодовой и материнской частями плаценты; внутримышечно – кордовую кровь 0,05 мл / кг м. т. на первые и пятые сутки. С третьих суток с утра вводили внутриматочно пять свечей пробиотика «Супозит плюс» один раз в двое суток, а вечером внутримышечно 10 мл «Доцитола» до полного отделения коровьего последа.
т. на первые и пятые сутки. С третьих суток с утра вводили внутриматочно пять свечей пробиотика «Супозит плюс» один раз в двое суток, а вечером внутримышечно 10 мл «Доцитола» до полного отделения коровьего последа.
Животным контрольной группы мануальное отделение последа проводили после внутриматочного введения суппозитория «Йодопен». Всем животным, у которых наблюдалось ухудшение общего состояния с повышением температуры тела до 40,5 градусов, дважды внутримышечно применяли 15%-й раствор амоксицилина (один раз в 48 часов) по 10 мл на 100 кг м.т. и препарат «Аинил» (противовоспалительное нестероидное средство) 3 мл на 100 кг м.т.
В контрольной группе длительность неоплодотворяемости составляла 107,3±6,8 суток, а у коров, которых лечили консервативно, на 48,9 суток меньше. Это объясняется развитием хронических, субклинических, воспалительных процессов и дегенеративных изменений эндометрия матки, которые возникли на фоне оперативного отделения последа у коровы. При консервативном лечении у коров наблюдалось сокращение срока к проявлению полового цикла, от родов до первого осеменения и оплодотворения, а также повышение оплодотворяемости, уменьшение частоты гнойно-катарального эндометрита в 1,6-1,9 раз.
Задержание последа у коровы требует срочного вмешательства, так как редко проходит без осложнений. Если проблему не устранить вовремя, в дальнейшем придется тратиться на дорогостоящее лечение, а в некоторых случаях животное остается бесплодным.
Татьяна Кузьменко, член редколлегии Собкор интернет-издания «AtmAgro. Агропромышленный вестник»
Лечение задержания последа у коров в домашних условиях
Содержание статьи
Стельность у коров длится около 9 месяцев. Во время родов после рождения теленка должна выйти плацента — послед. Плацента у коровы должна выйти в течении 8 часов. Бывают случаи, когда отделение последа нарушается, что вызывает много неприятных последствий и может стать причиной гибели коровы. О задержание последа можно говорить спустя 8 часов после рождения теленка. Нарушение отделения плаценты встречается примерно в 5 % случаев. Но этот процент сильно возрастает в промышленных поголовьях и достигает 30 %. Нарушение отделения плаценты существенно снижает репродуктивную способность.
Причины нарушения отделения плаценты
Ветеринары выделяют способствующие и непосредственные причины нарушения отделения плаценты.
Факторы, вызывающие задержание отделения последа:
- содержание коров в ограниченном пространстве;
- истощение;
- ожирение;
- недостаточность физической активности скота;
- дефицит минералов в питании;
- многоплодная беременность.
Непосредственные причины нарушения отделения плаценты:
- матки;
- слабость послеродовых сваток;
- сращение плаценты с маткой.
Довольно часто, особенно в промышленных поголовьях, коровы слишком мало двигаются, что приводит к снижению мышечного тонуса матки. Слабый тонус матки во время отела вызывает задержание отделения плаценты. Физическое истощение и ожирение также являются причиной снижения тонуса матки. Недостаточность минеральных веществ в крови стельной коровы вызывает нарушения сократительной активности мышечных волокон.
Симптомы задержания отделения плаценты
Случаются два варианта нарушения отделения плаценты — полное и неполное. Полным нарушением отделения последа считают наличие внутри матки всей массы плаценты. О неполном отделении плаценты говорят в случаях задержания внутри матки частичек последа. У коровы плацента имеет вид толстого блина с бугристой поверхностью, обычно серо-белого цвета. Иногда на поверхности плаценты видны сосуды и лоскуты околоплодных оболочек. От центра последа отходит бурый тяж – пуповина. Плацента состоит из тесно сплетенных кровеносных сосудов. В случаи задержания последа внутри матки, он является идеальным резервуаром для размножения бактерий. Кров начинает разлагаться и становится питательной средой для роста патогенной микрофлоры. При распаде тканей плаценты, появляется резкий и неприятный гнилостной запах. Матка у коров прекрасно кровоснабжена и токсины из плаценты попадают прямо в кровь. Задержка последа вызывает развитие сепсиса и поражение абсолютно все органов и систем. Через два дня без лечения задержка плаценты может стать причиной гибели коровы.
Через два дня без лечения задержка плаценты может стать причиной гибели коровы.
Если на протяжении 6- 8 часов после рождения теленка не произошел выход последа или вышли не все его части, то говорят о нарушении отделения плаценты. Нарушение отделения оболочек плода вызывает тяжелую интоксикацию. Уже через пару часов после родов у коровы появляется слабость и вялость. У животного поднимается температура тела. Корова начинает стонать и беспокойно тужиться. Матка коровы воспаляется, развивается эндометрит и появляются сильные боли в животе. Животное не дает дотронуться к животу. У коровы развивается сепсис и септический шок. Начинает падать давление и учащаться сердцебиение.
При осмотре коровы, тело матки атонично. Животное мучается, горбится и пытается выдавить из себя остатки последа. Через день после задержания оболочек из половых органов начинает вытекать гноя и слизи. Состояние коровы постоянно ухудшается. Животное отказывается от еды и воды. В таких случаях без лечения прогноз неблагоприятный, обычно все заканчивается гибелью коровы.
У коров чаще встречаются неполное задержание плаценты. При осмотре из половых путей выпадает большая часть оболочек плода, которые свисают вниз. Корова вытягивает спину, подымает хвост и становится в позу для мочеиспускания.
Диагностика задержания отделения оболочек плода
Необходимо внимательно следить за процессом отела. Послед должен выйти вслед за теленком на протяжении 6-8 часов. Если за это время не произошло отделение оболочек нужно провести ревизию половых органов. Для этого необходимо тщательно вымыть руки и надеть высокие защитные одноразовые перчатки. Рука вводится в половые пути и проводится пристеночное ощупывание в поисках последа. В случае обнаружения оболочек плода или его частей можно говорить о задержании плаценты.
Очень важно проследить за выходом последа, так как коровы иногда сьедают плаценту. В таких случаях можно ложно предположить задержание отделения последа. Если плацента была съедена, состояние коровы не изменяется. Спустя некоторое время после поедания последа у коровы случается легкая диарея. При любых сомнения по поводу отхождения последа необходимо провести ревизию полости матки. После выхода плаценты нужно тщательно ее осмотреть и проверить целостность.
В таких случаях можно ложно предположить задержание отделения последа. Если плацента была съедена, состояние коровы не изменяется. Спустя некоторое время после поедания последа у коровы случается легкая диарея. При любых сомнения по поводу отхождения последа необходимо провести ревизию полости матки. После выхода плаценты нужно тщательно ее осмотреть и проверить целостность.
Если послед отделился не полностью, проводят ревизию матки и удаляют оставшиеся частички. Своевременное лечение и удаления последа и его частей, которые не отделились, является единственным способом предотвратить развитие сепсиса и токсического шока.
Лечение нарушений отделения оболочек плода
Лечение коровы с нарушением отделения последа должно быть своевременным и комплексным. Различают консервативные и ручные способы борьбы с задержанием оболочек плода.
Консервативный способ отделения плаценты
Консервативное лечение заключается в усилении тонуса мышц матки, предупреждении размножения микроорганизмов, и поддержании общего состояния организма коровы. В первые 6 часов после рождения теленка коровам дают выпить 2 литра воды с 500 г сахара. Также с целью естественной стимуляции сокращения матки выпаивают 5 литров околоплодных вод, которые предварительно разбавляют подсоленной водой.
В первые 6 часов после рождения теленка коровам дают выпить 2 литра воды с 500 г сахара. Также с целью естественной стимуляции сокращения матки выпаивают 5 литров околоплодных вод, которые предварительно разбавляют подсоленной водой.
Повышение тонуса матки приводит к увеличению силы схваток и способствует самостоятельному отхождению последа. С этой целью используют лекарственные средства, усиливающие сократительную способность мышц матки (окситоцин, питуитрин). Окситоцин вводят под кожу в дозе 30-60 ЕД. Питуитрин вводят в количестве 8-10 ЕД на 100 кг массы тела животного. Дополнительно подкожно вводят 0,5% раствор прозерина в количестве 2 мл. Тонизирующие маточные средства рекомендуют вводить трижды с интервалом в 6 часов.
Для общего поддержания защитных свойств корове каждые 12 часов внутривенно вводят 20% глюкозу (200-300 мл) и 10% раствор кальция хлорида (100-150 мл).
Для предупреждения заражения крови разлагающимся последом в матку вводят антибактериальные препараты. Для этого используют препараты Метромакс, Экзутер и фуразолидоновые палочки. Иногда с целью расщепления сращения плаценты со стенками матки в полость вливают раствор пепсина с соляной кислотой. Для приготовления раствора используют 20 г пепсина, 15 мл соляной кислоты и 300 мл чистой воды.
Для этого используют препараты Метромакс, Экзутер и фуразолидоновые палочки. Иногда с целью расщепления сращения плаценты со стенками матки в полость вливают раствор пепсина с соляной кислотой. Для приготовления раствора используют 20 г пепсина, 15 мл соляной кислоты и 300 мл чистой воды.
При неполном отделении в пупочную вену в тяже пуповины вводят 2 литра холодного гипертонического раствора натрия хлорида. После введения гипертонического раствора пуповину перевязывают. Отделение последа происходит примерно через 20 минут. Добиться отделения ворсин плаценты можно путем вливания в матку гипертонических солевых растворов. Для этого в полость матки вливают 4 литра 10% раствора поваренной соли или 25 % раствор магния сульфата.
Если медикаментозное лечение не приводит к выходу последа, переходят к ручному извлечению плаценты.
Оперативное лечение задержания последа
Любые манипуляции в полости матки коровы необходимо выполнять в защитной индивидуальной одежде. Для этого надевают халат с широкими рукавами, нарукавники и фартук. Руки тщательно моют, обрабатывают щеткой и ранки смазывают йодом. Затем надевают высокие гинекологические перчатки.
Для этого надевают халат с широкими рукавами, нарукавники и фартук. Руки тщательно моют, обрабатывают щеткой и ранки смазывают йодом. Затем надевают высокие гинекологические перчатки.
Извлечение последа рекомендуют проводить, используя эпидуральную анестезию. Для этого корове эпидурально вводят 10 мл 1% раствора новокаина. Левой рукой охватывают выступающую часть околоплодных оболочек и слегка натягивают. Затем свободную руку через половые пути запускают в полость матки. Аккуратными движениями сначала изучают содержимое и его отношение к стенкам матки. Если послед свободно находится в половых путях, его просто извлекают. Осуществив извлечение, матку повторно проверяют на наличие частиц оболочки плода.
Если плацента плотно связана со стенкой матки, то нельзя сразу силой удалять ее. Сначала пытаются помассировать стенки матки кулаком для повышения тонуса мышц матки. При сокращении мышц, сплетенные между маткой и плацентой сосуды начнут сокращаться и запустевать. Таким способом может удаться добиться отделения последа от стенок матки. В случае отсутствия эффекта, необходимо приступать к активному отделению плаценты. С помощью двух пальцев послед постепенно отделяют от тела матки. Во время отделения, левой рукой необходимо закручивать выступающую часть плаценты вокруг
В случае отсутствия эффекта, необходимо приступать к активному отделению плаценты. С помощью двух пальцев послед постепенно отделяют от тела матки. Во время отделения, левой рукой необходимо закручивать выступающую часть плаценты вокруг
оси.
После ручного извлечения последа в полость матки нужно ввести антибактериальные средства. Для этого используют раствор Люголя, пенициллин или стрептомицин. Также можно использовать средства Метромакс и Экзутер. Не стоит применять несколько антибиотиков одновременно.
Профилактика нарушений отделения последа
Профилактические действия основаны на предупреждении атонии мышц матки у коров. С этой целью способствую двигательной активности скота, достаточном ежедневном моционе. Коровы, которые готовятся к отелу, должны получать достаточное количество сбалансированного корма.
В случаях, если достаточное количество питательных веществ не может быть обеспечено путем рационального кормления, что бы предотвратить задержание плаценты используют витаминно минеральные добавки. За месяц до предполагаемого отела коровам начинают вводить витаминные препараты. Например, средства Тетравит и Тривитамин вводятся в дозе 10 мл внутримышечно каждые 10дней.
За месяц до предполагаемого отела коровам начинают вводить витаминные препараты. Например, средства Тетравит и Тривитамин вводятся в дозе 10 мл внутримышечно каждые 10дней.
Распространенные патологии отелов коров: от причин до лечения
Патологии родов относятся к распространенным причинам вынужденной прирезки, сдачи на мясоперерабатывающие предприятия, отхода коров, потери молодняка, снижения молочной и мясной продуктивности. К тому же, помощь, оказываемая коровам-роженицам, сопряжена с дополнительными временными, физическими и финансовыми издержками. Все это негативно сказывается на рентабельности скотоводческой продукции. Поэтому сегодня мы познакомимся с основными патологиями, дающими о себе знать у коров во время отелов.
1. Задержка последа у коров
О такой проблеме говорят, когда плодные оболочки задерживаются в половой системе самок сверх нормативного времени:
- коровы – больше 6 часов;
- кобылы – от 30 минут;
- козы и свиньи – больше 3 часа.

Отсчет времени ведется с момента появления на свет теленка.
Начинающие скотоводы задержку последа часто связывают с послеродовым периодом. На самом деле речь идет о проблеме рожениц, то есть о патологии отела. Послед задерживается как минимум у 1/3 коров. Такая проблема ведет к 17-процентной выбраковке высокоудойных самок, ухудшению количественных и качественных показателей молочной продуктивности, 10-процентной потере живого веса, развитию новых недугов, например, эндометритов – воспалительных процессов, поражающих слизистую матки.
Что касается первопричин проблемы, это могут быть слабые схватки и атония матки, недостаточная обеспеченность коров элементами питания. Вероятность проблемы выше при отсутствии моциона, чрезмерного отложения жира, бруцеллеза и других инфекций.
Патология опасна тем, что процесс разложения с выступающей части последа переходит в матку. Через пару суток это подтверждается гнилостным запахом. Продукты разложения, в том числе вещества токсической природы оказываются в кровяном русле. Отсюда интоксикация, сопровождающаяся угнетенным состоянием коровы, низкими удоями. Проблемную корову можно определить визуально – горбится.
Продукты разложения, в том числе вещества токсической природы оказываются в кровяном русле. Отсюда интоксикация, сопровождающаяся угнетенным состоянием коровы, низкими удоями. Проблемную корову можно определить визуально – горбится.
Важно: молоко, получаемое от коровы, у которой задержался послед, выпаивать молодняку нельзя, так как это провоцирует диарею.
Задержка последа бывает полной и частичной. В первом случае плодные оболочки не видны, в во втором они свисают до скакательного сустава и ниже.
В основе лечения лежит быстрое отделение последа с одновременным сохранением тонуса матки, ее сократимости. Животным назначается консервативное и оперативное лечение.
Консервативное лечение – отделение хориона с помощью окситоцина, питуитрина, прозерина, карбохолина и др.
Народная ветеринария предлагает следующую эффективную микстуру: настойка белой чемерицы + вода. Соотношение ингредиентов – 3 к 97. Средство предназначено для внутриматочного введения. Разовая доза – 100-150 мл.
Средство предназначено для внутриматочного введения. Разовая доза – 100-150 мл.
Неплохой результат дают приборы, усиливающие сократительную функцию матки. Параллельно эти электронные аппараты способствуют восстановлению рефлекторной сократительной функции миометрия.
Когда консервативное лечение не дает ожидаемого эффекта (через сутки в летнюю пору и двое суток в зимний период), прибегают к оперативному отделению последа.
Чтобы после принятых мер исключить вероятность воспалительных процессов, вводится экзутер (2 палочки), септометрин (пару капсул) и др.
Некоторые ученые и производственники советуют отделять послед «сухим» способом. После такой процедуры в матку не вводят антисептический раствор.
Самый эффективный подход к решению проблемы – ее недопущение. Основные профилактические мероприятия:
- создание и поддержание на должном уровне комфортных для коров условий;
- оптимизация кормовой базы и нормированное кормление с учетом всех факторов, определяющих количество скармливаемых кормов.

2. Слабые схватки и потуги у коров
Речь идет о редких и коротких сокращениях матки (вкупе с брюшным прессом), которые ведут к задержке появления на свет теленка. Иногда плод вовсе не выводится. При этом результатом несвоевременной помощи является гибель плода.
Патология бывает:
- первичной – начинается, когда раскрывается шейка матки. С такой проблемой скотоводы чаще сталкиваются зимой. Факторы, провоцирующие первичные слабые схватки и потуги: безвыгульное содержание и ошибки, допущенные при кормлении скота. У многоплодных особей такая проблема дает о себе знать чаще. Нередки случаи, когда она наследуется дочерями от матерей;
- вторичной – возникает, когда бурные или нормальные схватки и потуги не сопровождаются выведением плода. Отсутствие помощи в подобных ситуациях – это причина полной атонии матки и гибели теленка. У проблемных коров задерживается послед, выворачивается влагалище, выпадает матка.
Борьба с первичной патологией не допускает спешный разрыв неразорвавшегося плодного пузыря. Чтобы повысить тонус, корове в вену вводят 40-процентную глюкозу (разовая доза – 150-200 мл) и 10-процентный глюконат кальция (100-150 мл). Дальнейшая помощь животному включает введение под кожу окситоцина или питуитрина, массирование матки через стенку прямой кишки. Не выполняйте это самостоятельно, лечение без соответствущей квалификации может привести к гибели животного, обратитесь к ветеринару.
Чтобы повысить тонус, корове в вену вводят 40-процентную глюкозу (разовая доза – 150-200 мл) и 10-процентный глюконат кальция (100-150 мл). Дальнейшая помощь животному включает введение под кожу окситоцина или питуитрина, массирование матки через стенку прямой кишки. Не выполняйте это самостоятельно, лечение без соответствущей квалификации может привести к гибели животного, обратитесь к ветеринару.
Стратегия борьбы с вторичными слабыми схватками и потугами включает:
- определение первопричины проблемы;
- стимулирование моторики матки эпидуральным введением 1-процентного новокаина. Разовая доза – 15-20 мл. Место введения средства – область, ограниченная первым и вторым позвонками хвоста.
3. Сухие роды у коровы
Сухой отел протекает при недостаточно увлажненных родовых путях, когда просвет раскрытой шейки матки невелик.
В подобных случаях в полость матки вводятся ослизняющие жидкости. Ветеринары обычно пользуются льняным отваром, вазелиновым маслом. Подходит и мыльная вода, растворенный крахмал и даже обычный вазелин.
Подходит и мыльная вода, растворенный крахмал и даже обычный вазелин.
Важно: если предварительно не увлажнить половые пути и приложить усилие по извлечению теленка, у животного выворачивается влагалище, которое вправить удается не всегда.
4. Скручивание матки у коров
Скручиваться может как вся матка, так и один из ее рогов. Проблема возникает из-за того, что рога с краниальной стороны лишены связок, фиксирующих их.
Чтобы матка скрутилась, корове достаточно резко повернуться или упасть. Патология возникает и при тимпании.
Скручивание матки не сопровождается какими-то характерными симптомами. Единственное, что может указывать на проблему – это затянувшийся отел вкупе с беспокойным поведение коровы. Во время вагинального исследования можно заметить винтообразную складчатость, а ректального – обнаружить сильно натянутую маточную связку, отечность матки.
Эффективность помощи животному в первую очередь зависит от масштаба проблемы. Например, 360-градусное скручивание матки ведет к закрыванию сосудов. Отсюда некроз и гибель плода. Иногда матка отпадает и начинает «блуждать».
Например, 360-градусное скручивание матки ведет к закрыванию сосудов. Отсюда некроз и гибель плода. Иногда матка отпадает и начинает «блуждать».
При незначительном скручивании плод извлекается с помощью его поворачивания в противоположную сторону. При этом роженица должна лежать на боку со связанными и поджатыми к корпусу конечностями. Делается резкий поворот в сторону, в которую скручена матка. Степень поворота контролируется посредством руки, введенной в родополовые пути.
Эффективным решением проблемы является метод Шефера. Он применим на животном, матка которого скручена влево. Корова располагается на левом боку со связанными задними и передними конечностями. Берется прочная доска. Один из ее концов прикладывается сверху к животу. Второй конец доски касается пола. Матка возвращается в нормальное положение путем поворачивания коровы в левую сторону. При этом матка зафиксирована. Для расправления матки обычно достаточно нескольких поворотов. На всю процедуру затрачивается до шести минут. Если решить проблему таким способом не получается, последнее, что можно сделать – провести операцию – поправить матку после проведения кесарево сечения. Такой способ эффективен, но трудоемок и требует наличия у специалиста определенных знаний и навыков.
Если решить проблему таким способом не получается, последнее, что можно сделать – провести операцию – поправить матку после проведения кесарево сечения. Такой способ эффективен, но трудоемок и требует наличия у специалиста определенных знаний и навыков.
Схемы лечения задержания последа у коров
Существует несколько схем консервативного медикаментозного лечения задержания последа у коров.
Если послед не вышел под действием последовых схваток на протяжении 4-6 часов после рождения плода, тогда он считается задержавшимся. Лечение задержания последа у коров включает консервативные и оперативные методы. Лечение нужно проводить немедленно, чтобы животное не заболело клиническим эндометритом.
Консервативный метод лечения задержки последа у коров заключается в проведении туалета наружных половых органов и свисающей части последа, и вводе определенных препаратов.
Существует несколько схем консервативного лечения задержания последа у коров.
Первая схема: корову выпаивают 2-3 литрами молозива с равным по объему количеством воды с добавлением хлорида натрия (30-40 г) или же 800 мл патоки, которую разбавляют в 7 литрах подсоленной воды (100 г поваренной соли). Выпаивание такими водными смесями повторяют через каждые 5-6 часов 2-3 раза в день.
Вторая схема: внутривенно вводят 10%-ный раствор глюконата или хлорида кальция (100-150 мл) и 40%-ный раствор глюкозы (200-300 мл) с добавлением окситоцина (15-20 ЕД). Можно вводить 10%-ный хлорид кальция (150 мл) вместе с 1%-ным раствором метиленовой сини (200-300 мл) на 40%-ном растворе глюкозы.
Если после 24-часового лечения по указанным схемам положительного результата не достигнуто, тогда используют такие методы лечения задержки последа у коров:
· Внутриматочное введение 30%-ного раствора ихтиола (300-500 мл) и внутриоральное применение 1%-ного раствора новокаина (100-150 мл) на 10%-ном растворе глюкозы в сочетании с инъекциями окситоцина (по 40-60 ЕД).
· Между слизистой оболочкой матки и последом вводится водный раствор 20 г пепсина (300 мл) и соляная кислота (15 мл) дважды в день с интервалом 5-8 часов.
· Внутриматочно вводят 200-300 мл натурального желудочного сока или прокипяченного и остуженного 5-10%-ного раствора хлорида натрия (3-4 литра).
· Внутриматочно вводят раствор пенициллина со стрептомицином.
К безмедикаментозным методам лечения задержания последа у коров относится:
1. Введение в полость матки электроотделителя последа.
2. Сразу же после рождения плода отрезать ножницами пуповину (20-30 см), оставшейся с последом, и выжать из ее просвета всю кровь.
3. Воздействие на биологически активные точки при помощи иглоукалывания и электропунктуры.
Оперативное лечение задержки последа у коров проводится через 48 часов после отела. Сначала проводится инъекция, что активизирует моторику матки и создает благоприятные условия для свободного доступа рукой к любому карункулу (включая последний), на которых задерживается послед. Хирургическое отделение последа происходит по общепринятой методике.
Хирургическое отделение последа происходит по общепринятой методике.
Купить препараты для коров при задержании последа Мастометрин р-р для инъекций 10 мл, Утеротон (1 фл.х 100 мл), Синестрол 2% (1 фл.х 10 мл).
Удерживаемые плодные мембраны коров — Репродуктивная система
Задержка плодных оболочек или задержка плаценты обычно определяется как невозможность изгнания плодных оболочек в течение 24 часов после родов. Обычно изгнание происходит в течение 3–8 часов после рождения теленка. Заболеваемость среди здоровых молочных коров составляет 5–15%, тогда как среди мясных коров заболеваемость ниже. Заболеваемость увеличивается при аборте (особенно при бруцеллезе или грибковом аборте), дистоции, рождении двойни, мертворождении, гипокальциемии, высокой температуре окружающей среды, пожилом возрасте коровы, преждевременных родах или индукции родов, плацентите и нарушениях питания. Коровы с сохраненными плодными оболочками подвержены повышенному риску метрита, смещения сычуга и мастита.
Коровы с сохраненными плодными оболочками подвержены повышенному риску метрита, смещения сычуга и мастита.
Удержание плодных оболочек опосредуется нарушением миграции нейтрофилов к границе плаценты в околородовой период. Нарушение функции нейтрофилов распространяется на послеродовой период и, вероятно, опосредует признанные осложнения, связанные с задержкой плодных оболочек. Коровы с сохраненными плодными оболочками имеют повышенную концентрацию кортизола и пониженную концентрацию эстрадиола на поздних сроках беременности.У них также может быть измененное соотношение простагландина (PG) E 2 : PGF 2 . У пораженных коров повышается сократимость матки. (Отслоение плаценты, а не перистальтика матки, отвечает за сохранение плодных оболочек.)
Диагноз обычно очевиден, поскольку через более 24 часов после родов выявляются дегенерирующие, обесцвеченные и в конечном итоге зловонные оболочки. Иногда задержанные мембраны могут оставаться внутри матки и не быть очевидными, и в этом случае об их присутствии могут свидетельствовать выделения с неприятным запахом. В большинстве случаев признаков системного заболевания нет. Если видны системные признаки, они связаны с токсемией. Несложное удержание плодных оболочек неприглядно и неудобно для доярок и дояров, но, как правило, не вредит корове. Однако коровы с сохраненными плодными оболочками подвержены повышенному риску развития метрита, кетоза, мастита и даже аборта при последующей беременности. Коровы, у которых когда-то были сохранены плодные оболочки, подвергаются повышенному риску рецидива при последующих отелах.
В большинстве случаев признаков системного заболевания нет. Если видны системные признаки, они связаны с токсемией. Несложное удержание плодных оболочек неприглядно и неудобно для доярок и дояров, но, как правило, не вредит корове. Однако коровы с сохраненными плодными оболочками подвержены повышенному риску развития метрита, кетоза, мастита и даже аборта при последующей беременности. Коровы, у которых когда-то были сохранены плодные оболочки, подвергаются повышенному риску рецидива при последующих отелах.
Удаление удерживаемых мембран вручную не рекомендуется и потенциально опасно. Допускается обрезка лишней ткани, которая нежелательна для дрессировщиков и способствует сильному загрязнению половых путей. У необработанных коров перепонки удаляются через 2–11 дней. Было обнаружено, что регулярное использование внутриматочных противомикробных препаратов не приносит пользы и может быть вредным. Хотя окситоцин, эстрадиол, PGF 2α и пероральные препараты кальция рекомендовались в разное время, не было показано, что они ускоряют изгнание задержанных мембран или предотвращают осложнения. При наличии системных признаков заболевания показано системное лечение противомикробными препаратами. В стадах, в которых частота задержки плодных оболочек недопустимо высока, следует искать и устранять предрасполагающие причины. Было обнаружено, что добавки с витамином E и селеном для стада с дефицитом этих питательных веществ являются полезными.
При наличии системных признаков заболевания показано системное лечение противомикробными препаратами. В стадах, в которых частота задержки плодных оболочек недопустимо высока, следует искать и устранять предрасполагающие причины. Было обнаружено, что добавки с витамином E и селеном для стада с дефицитом этих питательных веществ являются полезными.
Ветеринары теперь рекомендуют оставлять задержанную плаценту в покое, чтобы не повредить матку
Большинство коров «чистятся» вскоре после отела, отделяя плацентарные оболочки в течение 2–12 часов.Если это длится более 12 часов, это называется задержкой плаценты или задержкой плодных оболочек, по словам доктора Русса Дейли (ветеринарного врача-терапевта, Государственный университет Южной Дакоты). «Когда я практиковал, мы не рассматривали возможность какого-либо вмешательства до тех пор, пока плацента не задерживалась до 72 часов, но наше понимание того, как лучше всего лечить эти проблемы, изменилось», — говорит он.
Доктор Билл Лиас из Межгосударственной ветеринарной клиники, Брэндон, Южная Дакота, говорит, что ветеринары рекомендовали удалить плаценту, если корова не очистилась в течение дня или около того, но исследования показали, что лучше просто оставить их в покое.«Когда я закончил ветеринарную школу, стандартной практикой было удаление плаценты, но в последние годы мы обнаружили, что это не лучший путь для здоровья коровы и ее будущей фертильности; лучше просто оставить этих коров в покое, — говорит Лиас.
Дейли говорит, что в прошлом стандартной практикой было, чтобы ветеринар вручную отсоединял насадки и удалял плаценту. «Мы думали, что нужно избавиться от него, чтобы корова не заразилась. Мы узнали, что это вмешательство может повредить матку больше, чем просто оставить ее в покое », — говорит Дейли.
«Когда вы вручную удаляете плаценту, исследования на дойных коровах показали, что это может задержать функциональный цикл охоты на 20 дней дольше по сравнению с коровами, которых оставили одних только для нормального отделения плаценты. Попытки удалить эти оболочки могут принести больше вреда, чем пользы », — объясняет он. Легкая местная инфекция, как правило, проходит сама по себе и не влияет на способность коровы к своевременному повторному размножению.
Попытки удалить эти оболочки могут принести больше вреда, чем пользы », — объясняет он. Легкая местная инфекция, как правило, проходит сама по себе и не влияет на способность коровы к своевременному повторному размножению.
«Близнецы часто рождаются немного раньше, и даже если они не рождаются рано, близнецы — еще одна причина, по которой корова может удерживать плаценту.Причиной также могут быть тяжелые роды. Обычно это индивидуальные случаи с животными, а не проблема стада. Доктор Расс Дейли, ветеринарный врач СДГУ
«Мне до сих пор время от времени звонят люди, которые хотят, чтобы я почистил корову, и я должен сказать им, что мы больше этого не делаем. Когда мы пытаемся удалить эти мембраны, всегда существует риск повреждения. Есть места прикрепления, где плацента соединяется со слизистой оболочкой матки — карункулы в матке прикрепляются к семядолям плаценты.У коровы определенное количество карункулов, и если они оторваны, они не восстанавливаются. Определенное количество из них требуется для поддержки беременности, поэтому не рекомендуется вручную пытаться удалить плаценту и рисковать повреждением этих карункулов », — говорит он.
Определенное количество из них требуется для поддержки беременности, поэтому не рекомендуется вручную пытаться удалить плаценту и рисковать повреждением этих карункулов », — говорит он.
«Мы также рискуем внести больше загрязняющих веществ в матку, когда заходим внутрь и пытаемся удалить плаценту. Сегодняшний стандарт ухода и рекомендация производителям — оставить этих коров в покое, и у большинства из них все хорошо », — говорит Лиас.
Часто лечение не требуется; оболочки отделяются сами по себе через несколько дней (иногда до недели или 10 дней), и с коровой все будет в порядке, но иногда задержка плаценты может привести к серьезной инфекции. «Держите корову в чистом и сухом помещении, пока она не сбросит эти перепонки. Иногда в году это сложно, — говорит Лиас.
Часто корове лучше жить на пастбище, передвигаясь, чем запираться в грязном загоне. «Основным осложняющим фактором является занесение инфекции, когда эти мембраны свисают, а пациентка лежит в навозе или грязи», — говорит Лиас. Плацента может действовать как фитиль, доставляя болезнетворные микроорганизмы прямо в матку. За любой коровой, у которой остается плацента, следует внимательно следить, чтобы убедиться, что у нее не разовьется инфекция. Матка, как правило, может справиться с местной инфекцией и вылечиться, но если инфекция перейдет в системный характер, корове обязательно понадобится помощь.
Плацента может действовать как фитиль, доставляя болезнетворные микроорганизмы прямо в матку. За любой коровой, у которой остается плацента, следует внимательно следить, чтобы убедиться, что у нее не разовьется инфекция. Матка, как правило, может справиться с местной инфекцией и вылечиться, но если инфекция перейдет в системный характер, корове обязательно понадобится помощь.
«Наш лучший совет — оставить корову в чистом месте и присмотреть за ней. С большинством коров все будет в порядке, но если она заболеет, проконсультируйтесь с ветеринаром. Если корова остается нормальной, с хорошим аппетитом, она не нуждается в лечении, даже если на чистку у нее уходит неделя или больше.Если они не заболеют, у этих коров все будет хорошо, и они будут производить повторное размножение по графику. Коровы — очень выносливые животные! » — говорит Лиас.
Если корова перестает кормить, у нее может подняться температура и, вероятно, потребуется лечение. Обратитесь к ветеринару. Он или она, вероятно, порекомендуют системные антибиотики и, возможно, противовоспалительные препараты, сказал Лиас. В тяжелых случаях может потребоваться промывание матки антисептиком ветеринаром. Матка, как правило, может справиться с местной инфекцией и вылечиться, но если инфекция перейдет в системный характер, корове обязательно понадобится помощь.
В тяжелых случаях может потребоваться промывание матки антисептиком ветеринаром. Матка, как правило, может справиться с местной инфекцией и вылечиться, но если инфекция перейдет в системный характер, корове обязательно понадобится помощь.
«Такое лечение может понадобиться только в некоторых случаях. Если люди беспокоятся о свисании гнилого материала, они могут обрезать эту часть, а остальное оставить само по себе », — говорит Дейли. Раньше люди думали, что было бы полезно привязать палку или что-то еще к свисающим оболочкам, чтобы прибавить вес, чтобы помочь постепенно вытащить остальные, но то, что еще находится в матке в этот момент, все еще прикреплено; соединения должны разрушиться, чтобы весь этот материал мог высвободиться.Эти связи разорвутся, когда будут готовы.
В прошлом многие коровы с задержкой плаценты также получали окситоцин или препараты, такие как лютализ и простагландин, после отела. «Большинство сегодняшних данных показали, что эти методы лечения действительно не очень полезны», — говорит Лиас. «Матка крупного рогатого скота больше не восприимчива к окситоцину примерно через 24 часа после отела, и не показала особой пользы с точки зрения помощи корове в чистоте», — говорит он.
«Окситоцин — это лекарство, вызывающее сокращение матки», — говорит Дейли.«Это не препарат длительного действия; в организме животного он длится недолго. Мы обнаружили, что на самом деле он не очень способствует ускорению отделения плодных оболочек. Сдавливание матки не способствует ухудшению этой связи », — говорит он.
«Между плацентой и маткой имеется плотное соединение, и окситоцин не влияет на эту связь; он просто стимулирует маточные сокращения ». Если плацента уже отслаивается, сокращения могут помочь прохождению этих мембран, но если соединения еще не разорваны (что обычно имеет место в случае задержанной плаценты), потребуется время, чтобы они распались и разошлись, и окситоцин бесполезен.
ПРИЧИНЫ — Задержку плаценты могут вызывать несколько факторов, в том числе состояния отдельных животных и состояния стада. Дейли сказал, что независимо от причины, все задержанные плаценты следует лечить — или не лечить — одинаково. Инфекционные причины могут включать заболевания, приводящие к аборту. Аборты по любой причине могут привести к задержке плаценты. Каждый раз, когда корова преждевременно телится — абортированный плод, близнецы или недоношенный теленок — плацента обычно не выходит нормально, и требуется время, чтобы прикрепления распались и освободились позже.
Лиас говорит, что есть ряд причин, по которым корова может рано отелиться — аборт, инфекция, токсическое поражение, преждевременный теленок, близнецы и т. Д. «Мы почти всегда видим задержку плаценты в таких ситуациях. Недостаток питания также может быть причиной. Среди молочных коров, особенно у коров с низким содержанием кальция или у которых есть молочная лихорадка, гораздо выше заболеваемость. Задержка плаценты также связана с дефицитом витамина А, витамина Е и селена, а иногда и меди. Причин, связанных с питанием, может быть больше, чем мы знаем », — говорит Лиас.
«Если производители начинают наблюдать более чем несколько случаев задержки плаценты без общих и логических причин, им следует оценить свою программу питания. Если у вас нормальные роды, но частота задержки плаценты выше, чем обычно, проконсультируйтесь с диетологом и посмотрите, находятся ли уровни витаминов и минералов в корме на должном уровне ». Возьмите пробы корма и, возможно, некоторые пробы крови у коров, чтобы проверить их минеральный статус.
Другой причиной случайной задержки плаценты могут быть очень худые или очень толстые коровы.Лучшая профилактика — это хорошее состояние коров, хорошее питание и хорошее здоровье.
«Аборт или ранний теленок, вероятно, являются самым высоким риском задержки плаценты», — говорит Дейли. «Близнецы часто рождаются немного раньше, и даже если они не рождаются рано, близнецы — еще одна причина, по которой корова может удерживать плаценту. Причиной также могут быть тяжелые роды. Обычно это индивидуальные случаи с животными, а не проблема стада. Если производители видят много задержанной плаценты без причины, такой как аборт или тяжелый отел, это может быть признаком того, что в стаде что-то не так.Если это нормальный отел, и вы видите, что коровы без видимой причины вешаются на плаценту, наиболее распространенным фактором стада в таких ситуациях является дефицит витамина Е и селена », — говорит Дейли.
Причины и методы лечения задержанной плаценты
Программы кормления стада и минеральные вещества могут увеличить количество случаев задержки плаценты в стаде.(DTN / Progressive Farmer, фото Дэна Миллера)
Д-р Кен Макмиллан
Дополнительный редактор
ВОПРОС
В прошлом году у нас было несколько коров с задержкой плаценты. В конце концов они прошли, но что нам делать в таких случаях? Наш старый ветеринар выходил, промывал матку и давал антибиотики.Он на пенсии, а ближайший ветеринар далеко.
ОТВЕТ
Мы рекомендуем не использовать антибиотики в течение как минимум трех дней, если корова не больна. Мы часто рекомендуем инъекции Lutalyse или другого простагландина. Эти препараты вызывают сокращение матки и способствуют изгнанию плаценты.
Легкая контролируемая инфекция в местах прикрепления плаценты и матки может фактически способствовать ее высвобождению. Никогда не пытайтесь выдернуть плаценту.Сила тяжести оказывает мягкое и постоянное давление на плаценту. Потянув за нее, вы можете оставить прикрепленные мелкие детали; они будут проходить дольше и с большей вероятностью вызовут серьезную инфекцию.
Несмотря на то, что существует множество доказательств против рутинных маточных инфузий, я все же считаю, что в некоторых случаях они могут быть полезны. Если корова не ест, могут быть показаны пероральные или внутривенные жидкости и другие поддерживающие меры. Коровам с ректальной температурой от 102,5 ° F до 103 ° F (или выше), вероятно, потребуется более агрессивное лечение у ветеринара.
С подобными случаями часто можно справиться более эффективно и рентабельно, если доставить животное в кабинет ветеринара. Поскольку все больше и больше производителей начинают беспокоиться о доступе к ветеринарным врачам, специализирующимся на крупных животных, я хотел бы попросить, чтобы они рассматривали этот подход к лечению там, где это имеет смысл.
Наконец, когда есть проблемы с задержкой плаценты, обратите внимание на программу питания и минеральных веществ в вашем стаде, а также на общее состояние здоровья. Слишком толстые, слишком худые или страдающие недостатком минералов коровы более склонны к задержке плаценты.Обратите особое внимание на витамины А и Е, селен и йод.
Другие факторы, которые могут увеличить частоту задержки плаценты, включают болезни (бруцеллез, лептоспироз, инфекционный ринотрахеит крупного рогатого скота и вирусную диарею крупного рогатого скота), токсичные растения и тяжелые роды. Задержка плаценты чаще встречается при репродуктивных проблемах, включая близнецов, затяжных и тяжелых родах. Другим важным профилактическим шагом в этой области может стать селекция быков и развитие телок.
(AG / SK)
Авторское право 2019 DTN / The Progressive Farmer.Все права защищены.
Возникновению задержки плаценты предшествует воспалительное состояние и изменения энергетического обмена у молочных коров в переходный период | Журнал зоотехники и биотехнологии
Животные и рационы
Сто стельных молочных коров голштинской породы в Центре исследований и технологий молочного животноводства Университета Альберты (Эдмонтон, AB, Канада) были использованы в продольном исследовании.Шесть стельных многоплодных коров голштинской породы, которым был поставлен диагноз RP, и шесть здоровых контрольных коров (CON), которые были схожи по потомству, возрасту и состоянию тела, были отобраны для этого вложенного исследования случай-контроль (средний паритет группы CON составляет 3,2 ± 0,3. и средний паритет группы RP составляет 3,1 ± 0,3) возраст и оценка состояния тела (BCS; средний BCS для обеих групп составляет 3,17). Из 100 отобранных коров был диагностирован РП у 9 коров. Коровы, пораженные одновременно RP и другим заболеванием, были исключены из исследования, чтобы лучше охарактеризовать RP.Из 100 отобранных коров только 6 были поражены только РП. Все экспериментальные процедуры были одобрены Комитетом по политике и благополучию животных Университета Альберты в отношении домашнего скота, и за животными ухаживали в соответствии с руководящими принципами Канадского совета по уходу за животными [18].
Экспериментальный период длился 17 недель, начиная с -8 недель до отела до +8 недель после отела (т. Е. От -8 недель до +8 недель, 0 недель означает неделю отела) для каждой коровы. Коров содержали в индивидуальных стойлах с подстилкой из опилок и со свободным доступом к воде на протяжении всего эксперимента.За неделю до ожидаемого дня отела коров переводили в родильный дом и возвращали в стойла на следующий день отела. Диеты предлагались как ПМР для приема по желанию один раз в день в 08:00, чтобы позволить примерно 5% орт. Все TMR были разработаны для удовлетворения или превышения потребностей в питательных веществах сухостойных и первых 680-килограммовых дойных коров в соответствии с руководящими принципами Национального исследовательского совета [19]. Индивидуальное потребление сухого вещества (DMI) регистрировали ежедневно в течение 17 недель, вычисляя разницу между общими дневными рационами, даваемыми каждой корове с ортами на следующее утро.С начала лактации коров доили в стойлах дважды в день, в 05:00 и 16:00, а индивидуальный надой (MY) регистрировался в электронном виде. Образцы молока, собранные на d 0, 14, 21, 35 и 49 относительно родов (d 0 означает день отела), использовали для анализа состава молока. Состав молока, включая сырой белок (CP), молочный жир, лактозу, количество соматических клеток (SCC), азот мочевины молока (MUN) и общее количество твердых веществ (TS), анализировали с помощью спектроскопии в среднем инфракрасном диапазоне (MilkoScan 605; A / S Foss Electric , Хиллерёд, Дания) в Центральной лаборатории тестирования молока DHI в Эдмонтоне, Альберта.
Мониторинг клинического состояния здоровья
Состояние здоровья (HS) коров контролировалось ежедневно на основании клинических признаков заболевания обученными лицами и еженедельно практикующим ветеринарным врачом. Все перипородные заболевания и ветеринарное лечение регистрировали для каждой коровы на протяжении всего экспериментального периода. Диагноз беременности обычно ставился практикующим ветеринаром через 60–70 дней после осеменения. На основании данных искусственного оплодотворения (AI), подкрепленных информацией о диагнозе беременности, ожидаемая дата родов была оценена путем добавления 280 дней со дня искусственного оплодотворения.За всеми коровами наблюдали ежедневно, начиная с -8 недель до предполагаемой даты отела и продолжая до +8 недель после родов. Наблюдались различные внешние симптомы: ректальная температура, легкость отела, оценка состояния тела (BCS), температура тела и выделения из влагалища (цвет и консистенция).
В этом исследовании РП диагностировали, если у коров не происходило изгнание плодных оболочек в течение 24 часов после отела. Согласно ветеринарному протоколу коровам с РП вводили Тетрабол (Vetoquinol N.-А. Inc., lavatrie, Квебек, Канада) в полости матки.
Сбор образцов
Образцы крови были взяты из копчиковой вены один раз в неделю в 07:00 перед кормлением в период от –8 недель до родов до +8 недель после родов. Все образцы крови собирали в 10-мл пробирки Vacutainer (Becton Dickinson, Franklin Lakes, NJ, USA), давали возможность свернуться и хранили при 4 ° C до отделения сыворотки. Свернувшуюся кровь центрифугировали при 2090 x g при 4 ° C в течение 20 мин (центрифуга Rotanta 460 R, Hettich Zentrifugan, Туттлинген, Германия).Отделенную сыворотку аспирировали из супернатанта постепенно с помощью пипеток для переноса (Fisher Scientific, Торонто, Онтарио, Канада), не нарушая осадок. Отделенную сыворотку переносили в стерильную пластиковую пробирку объемом 10 мл (Fisher Scientific, Торонто, ОН, Канада). Все образцы сыворотки хранили при -80 ° C до анализа, чтобы избежать потери биологической активности и загрязнения, и размораживали на льду в течение примерно 2 часов перед использованием.
Анализы проб
Метаболиты сыворотки. Количественное определение сывороточного лактата, BHBA и NEFA проводилось ферментативным колориметрическим методом с использованием имеющихся в продаже наборов, предоставленных Sigma (St.Луис, Миссури, США), Stanbio Laboratory (Берне, Техас, США) и Wako Chemicals (Ричмонд, Вирджиния, США) соответственно. Подробные методы были описаны ранее Ametaj et al. [20]. Вкратце, в соответствии с инструкциями производителей нижние пределы обнаружения наборов составляли 0,06 мг / дл, 0,125 мкмоль / л и 0,50 мкэкв / л соответственно. Принцип лактатного анализа включает уменьшение бесцветной соли тетразолия за счет ферментативной реакции, связанной с NADH, с образованием формазана, при которой происходит изменение красного цвета, пропорциональное концентрации лактата.Тест BHBA включал основной принцип превращения сывороточного BHBA в ацетоацетат и NADH дегидрогеназой BHBA в присутствии NAD. Затем НАДН реагирует с хлоридом 2-п-иодфенил-3-п-нитрофенил-5-фенилтетразолия (INT) в присутствии диафоразы с образованием аддукта розового цвета, пропорционального концентрации BHBA в сыворотке. Принцип набора NEFA включал ацилирование кофермента A (CoA) жирными кислотами в сыворотке в присутствии ацил-CoA синтетазы и производство перекиси водорода в присутствии ацил-CoA оксидазы.Перекись водорода вместе с пероксидазой обеспечивает окислительную конденсацию 3-метил-N-этил-N-β-гидроксиэтил-О-анилина с 4-аминоантипирином с изменением пурпурного цвета, которое пропорционально концентрации NEFA в сыворотке. Все образцы тестировали в двух экземплярах, и абсорбция стандартов и образцов по сравнению с холостым тестом для лактата, BHBA и NEFA считывалась при 492, 505 и 550 нм, соответственно, в считывающем устройстве для микропланшетов (Spectramax 190, Molecular Devices Corporation, Саннивейл, Калифорния. , СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ). Вариация внутри анализа всех трех анализов контролировалась пределом коэффициента вариации (CV) <10%.
Цитокины сыворотки: Концентрацию IL-1 в сыворотке анализировали с помощью имеющегося в продаже набора ELISA для крупного рогатого скота (Cusabio Biotech Co. Ltd., Ухань, Китай) с mAb (моноклональными антителами), специфичными для IL-1, нанесенными на стенки предоставленные полоски для микропланшетов. Процедура включала основной принцип иммуноферментного анализа конкурентного ингибирования между биотин-конъюгированным IL-1 и IL-1 с предварительно покрытым антителом. Все образцы (50 мкл) тестировали в двух экземплярах в лунках для микротитрования с биотин-конъюгированным ИЛ-1 в соответствии с инструкциями производителя.Планшеты промывали промывочным буфером после инкубации в течение 60 мин при 37 ° C с последующим добавлением 50 мкл пероксидазы хрена (HRP) -авидина. Образцы инкубировали 30 мин при 37 ° C. Затем их трижды промывали буфером и в каждую лунку добавляли 50 мкл субстрата A и 50 мкл реагента субстрата B. После инкубации при 37 ° C в течение 15 минут полученную цветную реакцию считывали при 450 нм с помощью микропланшетного ридера (Spectramax 190, Molecular Devices Corporation, Саннивейл, Калифорния, США) в течение 10 минут и рассчитывали конечную концентрацию IL-1. с использованием 4-параметрической подгонки логистической кривой.Чувствительность этого анализа составляла 250 пг / мл, а CV внутри анализа составлял <10%.
Концентрацию IL-6 в сыворотке измеряли с помощью набора для ELISA для крупного рогатого скота, предоставленного Uscnk Life Science Inc. (Ухань, Китай), как описано производителем. Предел обнаружения анализа составлял 7,8 пг / мл, а вариация внутри анализа всех анализов IL-6 контролировалась пределами CV <10%. Принцип теста на ИЛ-6 включает иммуноферментный сэндвич-анализ, который показывает изменение желтого цвета, пропорциональное концентрации ИЛ-6.Образцы или стандарты добавляли в лунки микротитрационного планшета с конъюгированным с биотином антителом, специфичным к IL-6, со всеми образцами в двух экземплярах. Затем добавляли HRP-авидин и инкубировали планшет в течение 90 мин при 37 ° C в целом. После добавления субстрата 3,3,5,5-тетраметилбензидина (TMB) и раствора серной кислоты изменение цвета измеряли спектрофотометрически при длине волны 450 нм (Spectramax 190, Molecular Devices Corporation, Саннивейл, Калифорния, США).
Концентрацию TNF в сыворотке определяли с помощью коммерчески доступного набора ELISA для крупного рогатого скота (Bethyl Laboratories, Inc., Montgomery, TX, USA) с использованием метода, описанного ранее Iqbal et al. [21]. Вкратце, все образцы тестировали в двух экземплярах, и значения оптической плотности считывали при 450 нм на спектрофотометре для микропланшетов (Spectramax 190, Molecular Devices Corporation, Саннивейл, Калифорния, США). Диапазон обнаружения анализа TNF составлял от 0,078 до 5 нг / мл, а CV внутри анализа был ниже 10%.
Приложения для сыворотки: методы, используемые для измерения концентрации Hp (Tridelta Development Ltd., Co.Килдэр, Ирландия) и SAA (Tridelta Development Ltd.) в сыворотке были подробно описаны ранее Iqbal et al. [22]. Вкратце, образцы сыворотки на Hp не разводились. Минимальные пределы обнаружения для анализов Hp и SAA составляли 2,5 мг / мл и 18,8 нг / мл соответственно. Все образцы были протестированы в двух экземплярах, и оптическая плотность была измерена при 600 нм для Hp и 450 нм для SAA. Внутрианалитические вариации анализов APPs контролировались пределами CV на уровне не более 10%, и для тех образцов, превышающих 10%, анализировали повторно.
Статистический анализ
Для выполнения стандартного продольного исследования сравнений между двумя группами группа здоровых коров с коровами с РПЖ сравнивалась в каждый момент времени (-8, -4, диагноз заболевания и +4 недели).
Для параметрического анализа данных использовался ANOVA с помощью процедуры MIXED SAS (SAS Institute Inc., Кэри, Северная Каролина, США, версия 9.2) согласно следующей модели:
$$ {\ mathrm {Y}} _ { \ mathrm {i} \ mathrm {j} \ mathrm {k}} = \ upmu + {\ mathrm {S}} _ {\ mathrm {i}} + {\ mathrm {W}} _ {\ mathrm {j} } + {\ left (\ mathrm {S} \ mathrm {W} \ right)} _ {\ mathrm {i} \ mathrm {j}} + {\ mathrm {e}} _ {\ mathrm {i} \ mathrm {j} \ mathrm {k}} $$
, где Y ijk — наблюдения для зависимых переменных, μ — среднее значение по популяции, S i — фиксированный эффект состояния здоровья i (i = 1-2, больные коровы по сравнению со здоровым контролем отдельно), W j — фиксированный эффект j-й недели измерения (j = 1–4 или 1–17), SW ij — фиксированный эффект состояния здоровья по недельным взаимодействиям, а e ijk — остаточная ошибка.
Измерения, проведенные в разные недели на одной и той же корове, считались повторными измерениями в ANOVA. Ковариационная структура повторных измерений была смоделирована отдельно для каждой переменной ответа в соответствии с самыми низкими значениями статистики соответствия, основанной на байесовских информационных критериях, и была подобрана соответствующая структура. Степени свободы аппроксимировали методом Кенварда-Роджера (ddfm = kr).
Чтобы определить ранние индикаторы RP, средние сывороточные концентрации на неделе постановки диагноза, а также за −8 и −4 недели до ожидаемого дня родов сравнивали с использованием t -теста SAS 9.2 между здоровыми коровами и коровами с РП. Данные представлены в виде средних квадратов (LSM) и соответствующей стандартной ошибки среднего (SEM). Все статистические тесты были двусторонними. Значимость была заявлена при P <0,05, а тенденция была определена при 0,05 < P <0,10.
Многомерный анализ выполнялся с помощью MetaboAnalyst [23]. Рекомендуемые статистические процедуры для анализа главных компонентов (PCA) и дискриминантного анализа методом частичных наименьших квадратов (PLS-DA) выполнялись в соответствии с ранее опубликованными протоколами [23].Чтобы выполнить продольное исследование в сочетании с поперечными сравнениями между двумя группами, мы сравнили группу коров CON с группой коров RP в каждый момент времени (-8, -4, диагноз заболевания и +4 недели). В модели PLS-DA важность переменной на графике проекции (VIP) использовалась для ранжирования переменных на основе их важности в различении группы RP от группы коров CON. Переменные с наивысшими значениями VIP являются наиболее мощными групповыми дискриминаторами. Обычно значения VIP> 1 значимы, а значения VIP> 2 очень значимы.Профили биомаркеров и качество наборов биомаркеров определяли с использованием кривых характеристик приемника-оператора (ROC), рассчитанных с помощью MetaboAnalyst 3.0 [24]. Рассчитывались парная чувствительность и ложноположительные отношения (1-специфичность) на разных границах классификационного решения. Кривая ROC построена со значениями чувствительности по оси Y и соответствующими показателями ложноположительных результатов (специфичность 1) по оси X. Кривые ROC часто суммируются в один показатель, известный как площадь под кривой (AUC), который указывает на точность теста для правильного различения одной группы, такой как коровы RP, от коров CON.Если все положительные образцы ранжируются перед отрицательными, AUC составляет 1,0, что указывает на идеальный различающий тест. Были рассчитаны 95% доверительный интервал (ДИ) и значения Р. Примерное руководство для оценки полезности набора биомаркеров на основе его AUC: 0,9 ~ 1,0 = отлично; 0,8 ~ 0,9 = хорошо; 0,7 ~ 0,8 = удовлетворительно; 0,6 ~ 0,7 = плохо; 0,5 ~ 0,6 = сбой.
Задержка плаценты — обзор
Дополнительное лечение и контроль
Части задержанной плаценты, выступающие из влагалища, должны быть завернуты в пластиковую ректальную манжету, чтобы свести к минимуму оттекание фекальных бактерий после дефекации, хотя это предположение не было подтверждено.В качестве альтернативы можно иссечь выступающие остатки плаценты, хотя это может продлить время до изгнания, поскольку снижение веса плаценты может препятствовать тракции оставшейся плаценты в просвете матки. Производитель часто требует полного ручного удаления, но это не рекомендуется, поскольку исследования не продемонстрировали его эффективности.
Нестероидные противовоспалительные препараты часто назначают как часть начального лечения токсического метрита, якобы для устранения лихорадки и клинических признаков эндотоксемии.Введение одной дозы НПВП флуниксина меглумина (2,2 мг / кг внутривенно) в начале лечения послеродового метрита у дойных коров в дополнение к антибиотикам не улучшило результат по сравнению с введением только антибиотиков. 19 Добавление флуниксина меглумина (1,1 мг / кг, путь не указан, ежедневно в течение 3 дней) для лечения послеродового метрита у дойных коров парентеральным цефтиофуром (1 мг / кг, подкожно или внутримышечно [путь введения не ясен ] ежедневно в течение 5 дней) не улучшили скорость клинического излечения, концентрацию в сыворотке или крови биомаркеров воспаления, таких как сывороточный амилоид А и фибриноген, или элиминацию бактерий из матки. 20
Инфузия раствора коллагеназы (200 000 Ед, растворенных в 1 л 0,9% NaCl, содержащего 40 мг хлорида кальция и бикарбоната натрия) в пупочные артерии в течение 12 часов после родов является эффективным средством лечения задержанной плаценты. Таким образом, инъекции коллагеназы представляют собой эффективный метод профилактики септического метрита у крупного рогатого скота с задержкой плаценты. Однако раствор коллагеназы стоит дорого и не является широко доступным, а у некоторых животных этот метод затруднен из-за трудности определения неповрежденных пупочных артерий для инъекции.В результате инъекции коллагеназы редко используются в клинической ветеринарной практике. Эффективность инфузии антимикробных препаратов в пупочную артерию не была оценена должным образом.
Препараты Ecbolic были предложены для профилактики и лечения задержки плаценты у крупного рогатого скота. К ним относятся простагландины, производные спорыньи, окситоцин и антагонисты β 2 -адренорецепторов. Причина их использования заключается в том, что они стимулируют сокращения матки и физически способствуют изгнанию плодных оболочек.Как правило, все сходятся во мнении, что они неэффективны после того, как диагностирована задержка плаценты. Однако их использование может быть эффективным, если использовать сразу после отела. В частности, частое внутримышечное введение окситоцина, по-видимому, является наиболее эффективным средством предотвращения метрита, с рекомендуемым протоколом: 20 МЕ каждые 3 часа в послеродовые дни 0–3, 30 МЕ каждые 2 часа в дни 4–6 послеродового периода и 40 МЕ каждые 2 часа в течение 7–10 дней после родов. Крупное исследование показало, что внутримышечная инъекция окситоцина (30 МЕ) сразу после родов и через 2–4 часа спустя снижает частоту задержки плаценты и интервал от отела до зачатия.Фенпростален в дозе 1 мг подкожно, 25 мг динопроста трометамина внутримышечно или 20 МЕ окситоцина, назначенные большому количеству дойных коров в пяти коммерческих молочных стадах, не снизили частоту задержки плодных оболочек и не улучшили репродуктивную функцию. Подробный обзор не смог выявить никаких доказательств, подтверждающих использование эстрогенов или простагландинов в первые 7-10 дней после родов. 21
Обнаружение того, что задержка плаценты может быть вызвана дисфункцией нейтрофилов во время отела, дает основание для эпидемиологических доказательств того, что дефицит микроэлементов или витаминов (таких как селен и витамин E) связан с повышенной частотой задержки плаценты.В регионах с дефицитом селена добавление к рациону до 0,3 частей на миллион может снизить частоту задержки плаценты в стадах, которые получают полный смешанный рацион. Селен также можно вводить внутрипочечными болюсами или парентеральным введением препаратов витамина Е / селена в сухой период.
Подкожная вакцинация белковыми субъединицами или инактивированными бактериальными компонентами E. coli (экспрессирующая фактор вирулентности fimH ), F. necrophorum (продуцирующая протеин лейкотоксин) и T.pyogenes (продуцирующий белок пиолизин) может предотвратить послеродовой метрит и улучшить репродуктивную функцию. 22 Ожидается, что будет производиться коммерческая вакцина, включающая один или несколько из этих агентов.
Показатели потенциального риска задержки плаценты и других заболеваний у многоплодных коров
Задержка плаценты (РП), определяемая как плодные оболочки, не изгнанные в течение 24 часов после отела, является дорогостоящим заболеванием у многоплодных молочных коров, которое связано с подавлением иммунитета, инфекциями, повышенной мобилизацией липидов и истощением антиоксидантов, включая α-токоферол. , и это увеличивает риск других заболеваний (OD) в раннем периоде лактации.Раннее выявление коров с повышенным риском развития RP, OD или того и другого на ранней стадии лактации может улучшить эффективность лечения и привести к повышению надоя и репродуктивной способности. Чтобы определить индикаторы риска RP, OD или того и другого, мы использовали схему «случай-контроль» и сравнили многоплодных молочных коров, у которых развился RP (n = 32), с коровами, которые остались здоровыми (H; n = 32), или коровами, у которых развился OD. (n = 32) в раннем периоде лактации. Мы сравнили перипартальную оценку состояния тела (BCS), а также сывороточные концентрации α-токоферола, метаболитов [β-гидроксибутират (BHBA), холестерина, глюкозы, неэтерифицированных жирных кислот (NEFA) и мочевины N], гаптоглобина и макроминералов (i .е., кальций, магний и фосфор) на d -21, -14, -7, -3, -1, 0, 1, 3, 7, 14, 21, 28, 35, 42 и 49 послеродовой период. Кроме того, были рассчитаны средние концентрации в сыворотке для каждой коровы за последние 3 недели перед отелом, за 3 и 2 недели вместе, за последнюю неделю до отела и на утро после отела и сравнили между группами. У коров RP был более низкий BCS, чем у коров H или OD до 2 недель после родов. Во время предродовых периодов у коров RP и OD были более низкие концентрации α-токоферола (с поправкой или без учета концентрации холестерина) и более высокие концентрации NEFA и BHBA, чем у коров H.Таким образом, более низкий уровень предродовой BCS может быть ранним предиктором риска RP, а более низкие концентрации α-токоферола и более высокие концентрации NEFA и BHBA могут быть ранними предикторами заболевания.
Ключевые слова: биомаркер; молочная корова; болезнь; задержка плаценты; α-токоферол.
Границы | Метаболомика плазмы выявляет патогенез задержки плаценты у дойных коров
Введение
Задержка плаценты (РП), распространенное многофакторное послеродовое репродуктивное заболевание, проявляющееся как неспособность изгнать плодные оболочки в течение 24 часов после отела, увеличивает риск развития метрита и бесплодия и снижает производство и качество молока, вызывая большие финансовые потери в молочной промышленности (1–4).Этиология, патогенез и терапия RP были широко изучены многими исследователями (4-7). В настоящее время заболеваемость РП варьируется в зависимости от страны и стада, что тесно связано с управлением стадами и окружающей средой; физиологическое состояние коров: возраст, родство, наследственность, гормоны и питание; а также состояние телят, такое как мертворождение и двойняемость (4, 8). Сложная этиология и патогенез создают огромные проблемы для исследователей и ветеринаров-клиницистов при изучении патогенеза и схемы лечения RP (9–12).Патогенез RP до сих пор неясен, и есть четыре популярные гипотезы, объясняющие его: нарушение регуляции сокращений матки, дисфункция ворсинок хориона, воспалительный стресс и иммунные нарушения (13–15). Многие исследования также подтвердили, что изменения метаболитов в крови, цитокинов, воспалительных факторов, иммунных факторов и гормонов связаны с патогенезом RP (3, 13, 16, 17). Однако сложно прояснить сложный патогенез РП, затрагивающий метаболическую, иммунную, нервную и репродуктивную системы питания по показателям крови.
Метаболомика, довольно новая ветвь омических технологий, может отслеживать общие изменения низкомолекулярных метаболитов в физиологических или патологических условиях, что способствует обнаружению биомаркеров болезни, исследованию различных метаболических путей в развитии болезни и выяснению патогенеза болезни. (18–20). Большое количество исследований подтвердило, что биомаркеры, проверенные метаболомикой, не только участвуют в диагностике, но также участвуют в изучении патогенеза заболевания (21-24).Изменения в профилях метаболитов могут отслеживать и прогнозировать возникновение и развитие заболевания, но на них также легко влияет вмешательство множества смешанных факторов. Следовательно, для метаболомики важно исключить мешающие факторы при сборе образцов болезней.
Все больше данных подтверждают использование изменений биохимических профилей, антиоксидантной способности, цитокинов и гормонов в качестве биологических индикаторов RP (3, 25, 26). Также было признано, что некоторые репродуктивные гормоны и клетки Th2 и Th3 участвуют в процессе отделения и отхождения плаценты (16, 26, 27).Кроме того, большое внимание уделяется окислительному стрессу и изменениям биохимических профилей как причинам или результатам RP. В этом исследовании были обнаружены несколько биохимических индикаторов, маркеры окисления и антиоксидантной защиты, а также цитокины, а также метаболизм в плазме. На основании различных метаболитов и их целевых метаболических путей, в сочетании с изменениями биохимических показателей, маркеров окисления и антиоксидантов, а также цитокинов, целенаправленная регуляция метаболического состояния дойных коров с РП может быть полезной для выяснения патогенеза заболевания и развития эффективный график лечения.
В настоящем исследовании для выявления патогенеза RP у дойных коров был проведен нецелевой метаболизм в плазме, а также выявлены соответствующие биохимические индикаторы, маркеры окисления и антиоксиданты, а также цитокины, что полезно для выяснения патогенеза и разработки эффективного лечения. расписание.
Материалы и методы
Химические вещества и материалы
Все растворители для ЖХ [метанол, ацетонитрил (ACN) и изопропанол] относятся к категории чистоты для жидкостной хроматографии-масс-спектрометрии (ЖХ-МС) и приобретены у Fisher Scientific (Лафборо, Великобритания).Добавки для ЖХ-МС (муравьиная кислота и ацетат аммония) были приобретены у Sigma-Aldrich (Мадрид, Испания). Литохолевая кислота-D4 (LCAD4) была получена от Steraloids (Steraloids Inc., Ньюпорт, Род-Айленд, США). Фенилаланин-D5 (Phe-D5) был приобретен в Cambridge Isotope Laboratories (Тьюксбери, Массачусетс, США). Колонка с амидом ACQUITY UPLC BEH была приобретена у Waters (Милфорд, Массачусетс, США). Вакуумная пробирка для забора крови была приобретена у Laiwu Yaohua Pharmaceutical Packing Co., Ltd. (Шаньдун, Китай). Коммерческие наборы для биохимических параметров крови были предоставлены Ningbo Medical System Biotechnology Co., Ltd. (Нинбо, Китай). Малоновый диальдегид (кодовый номер: S0131S), набор для анализа Cu / Zn-SOD и Mn-SOD (кодовый номер: S0103) и набор для анализа общей глутатионпероксидазы (кодовый номер: S0058) были приобретены в Beyotime (Шанхай, Китай). Были использованы наборы для иммуноферментного анализа (ИФА) интерлейкина (ИЛ) -2, ИЛ-4, ИЛ-10 и фактора некроза опухоли альфа (ФНО-альфа) (кодовые номера: ab193682, ab277388, ab277386 и ab193683 соответственно). куплен в Abcam (Кембридж, США).
Животные и клинические образцы
В этом исследовании критерии включения дойных коров с РП были составлены для ограничения неоднородности выборки, вызванной смешивающими факторами.Все экспериментальные процедуры с участием животных проводились в соответствии с руководящими принципами Комитета по уходу и использованию животных Института животноводства и фармацевтических наук Ланьчжоу Китайской академии сельскохозяйственных наук (Ланьчжоу, Китай) (разрешение на использование животных: SCXK201808-1756). Все животные были получены с молочной фермы с 680 лактирующими коровами голштино-фризской породы на северо-западе Китая, и годовая частота встречаемости RP на этой молочной ферме составляла 10,4%. В настоящем исследовании RP определяется как плацента, которая не была изгнана в течение 24 часов после родов.Дойные коровы, зарегистрированные как здоровые дойные коровы, имели такое же соотношение, как и дойные коровы с РП и изгнанием плаценты в течение 24 часов после родов. Кроме того, у них не было инфекционных заболеваний и заболеваний обмена веществ. Все зарегистрированные дойные коровы имели хорошее психическое и физическое состояние и аппетит, оценку состояния тела (BCS) во время отела от 2,5 до 4,0 в соответствии с критериями, указанными в протоколе Edmonson et al. (28), анамнез ветеринарного карантина и истории болезни. Дойные коровы, перенесшие кесарево сечение во время предыдущего или текущего отела, смещение сычуга, ламинит или любую лекарственную терапию, за исключением профилактического лечения в стандартизированном ведении молочных ферм, были исключены из исследования.Чтобы ограничить влияние мешающих факторов на метаболические профили, в соответствии с критериями включения и исключения в эксперимент было включено 20 дойных коров: 10 здоровых коров были выбраны в качестве контрольной группы, а 10 коров с RP составили группу заболевания. Характеристики зачисленных дойных коров, а именно, BCS при отеле, количество и возраст, показаны в дополнительной таблице 1. Коровы в обеих группах имели схожие физические характеристики. Поскольку RP определялся как плацента, которая не была изгнана в течение 24 часов после родов, все образцы крови были собраны через 24 часа после отела для изучения метаболических изменений у дойных коров с RP.Все зарегистрированные дойные коровы имели ветеринарный карантин и истории болезни. Образцы крови зачисленных коров собирали из яремной вены через 24 ± 1 ч после родов в вакуумные пробирки с антикоагулянтом K2 EDTA или вакуумированные пробирки без антикоагулянта для получения плазмы и сыворотки соответственно. Вкратце, образцы крови оставляли при комнатной температуре на 1 час, а затем после центрифугирования при 1600 × g в течение 10 минут при 4 ° C супернатанты из вакуумных пробирок для предотвращения свертывания крови переносили в стерильные пробирки без каких-либо консервантов и хранят при -80 ° C до анализа.Свернувшуюся кровь в вакуумированных пробирках без антикоагулянта центрифугировали при 2,000 × g при 4 ° C в течение 20 мин, и супернатант переносили в стерильные пробирки.
Подготовка образца метаболита
В настоящем исследовании профили метаболитов в плазме молочных коров с RP были исследованы с помощью тандемной масс-спектрометрии с ультравысокой жидкостной хроматографией для скрининга потенциальных биомаркеров и дифференциальных метаболических путей RP и объяснения его патогенеза.Для анализа метаболомики ЖХ-МС 100 мкл плазмы смешивали с 400 мкл ледяной смеси ACN / метанол (1: 1, об. / Об.) Для депротеинизации. После встряхивания (30 с) образцы оставляли на 10 мин при -20 ° C, а затем центрифугировали (14000 × г , 10 мин) при 4 ° C. 400 мкл супернатанта каждого образца переносили в другую пробирку и упаривали досуха с помощью вакуумного концентратора. Каждый высушенный образец восстанавливали в 40 мкл ACN / вода (1: 1, об. / Об.), Обрабатывали ультразвуком в течение 10 минут, а затем центрифугировали в течение 15 минут при 13000 об / мин.Супернатанты переносили в аналитические флаконы и хранили при -80 ° C перед анализом ЖХ-МС. Мы объединили плазму из всех образцов (100 мкл), чтобы создать единый объединенный образец контроля качества (QC), который был приготовлен, как описано выше.
UPLC / QTOF-MS Анализ метаболитов плазмы
Таблицы Анализы ЖХ-МС / МС выполнялись с использованием системы ВЭЖХ Agilent 1290 Infinity (Agilent Technologies, Inc., Пало-Альто, США), соединенной с системой Triple TOF 5600 (AB SCIEX, Фостер-Сити, Калифорния, США).Образцы анализировали с использованием ACQUITY UPLC HSS T3 (колонки 1,8 мкм, 2,1 × 100 мм; Waters) для анализа HILIC. Каждый образец анализировали два раза в режимах положительной и отрицательной ионизации. Температура колонки и автоматического пробоотборника поддерживалась на уровне 25 и 4 ° C соответственно. Объем впрыска составлял 2 мкл, а скорость потока составляла 0,3 мл / мин как для положительных, так и для отрицательных ионов. Для режима положительной ионизации подвижные фазы A и B представляли собой 0,1% муравьиной кислоты в деионизированной воде и 0,1% муравьиной кислоты в ACN.Для режима отрицательной ионизации подвижные фазы A и B представляли собой 0,5 ммоль фторида аммония в деионизированной воде и ACN. Оптимизированная программа градиента установлена, как показано в дополнительной таблице 2.
Масс-спектрометрия проводилась путем ионизации электрораспылением в режимах положительных и отрицательных ионов. Для режима положительных ионов энергия столкновения была установлена на 50 В, потенциал декластеризации был установлен на 60 В, а напряжение всплытия ионов было установлено на +5000 В; для режима отрицательных ионов энергия столкновения была установлена на 20 В, потенциал декластеризации был установлен на -60 В, а напряжение распыления ионов было установлено на -5000 В.Другие параметры источника были следующими: газ источника ионов 1 был установлен на 40 фунтов на квадратный дюйм, газ источника ионов 2 был установлен на 80 фунтов на квадратный дюйм, газ завесы был установлен на 30 фунтов на квадратный дюйм, а температура источника была установлена на 650 ° C. Данные были получены в диапазоне отношения массы к заряду (m / z) 60–1000 Да со скоростью сканирования TOF MS 0,20 с / спектр и диапазоном m / z 25–1000 для сканирования производственных ионов с время накопления 0,05 с / спектр. Сканирование ионов продукта было получено с помощью информационно-зависимого сбора данных (IDA) с выбранным режимом высокой чувствительности.Были установлены следующие условия МС / МС: потенциал декластеризации: ± 60 В; энергия столкновения: 35 ± 15 эВ; исключение изотопов: в пределах 4 Да; и ионы-кандидаты для мониторинга за цикл: 6.
образцов плазмы из двух групп были проанализированы в случайном порядке во время анализа. Кроме того, образцы QC обнаруживались один раз через каждые пять исследуемых образцов для кондиционирования аналитической системы, коррекции сигнала и обеспечения качества.
Биохимический анализ сыворотки
Концентрации в сыворотке крови общего билирубина (T-bil), общего белка (TP), альбумина (ALB), глобулина (GLB), аланинаминотрансферазы (ALT), аспартатаминотрансферазы (AST), щелочной фосфатазы (ALP), креатинкиназы ( CK), мочевина (BUN), креатинин (CREA), глюкоза (GLU), триглицериды (TG) и общий холестерин (TC) определялись автоматическим биохимическим анализатором (ERBA XL 600®) в соответствии с инструкциями производителя для соответствующего коммерческие комплекты.
Маркеры окисления и антиоксиданты в сыворотке
Концентрации малонового диальдегида (MDA), супероксиддисмутазы (SOD) и глутатионпероксидазы (GSH-Px) определяли с помощью коммерческих наборов в соответствии с протоколами производителя. Вкратце, серийно разведенные стандарты MDA и тестовые образцы сыворотки были приготовлены и добавлены в лунку микропланшета, а затем 10 мкл исходного раствора цветного реагента MDA добавили в каждую лунку стандарта MDA и образца сыворотки и инкубировали при комнатной температуре в течение 20 минут. .10 мкл реакционного раствора добавляли в каждую клеточную пластину и инкубировали при комнатной температуре в течение 60 мин. Увеличение поглощения в каждой лунке планшета контролировали с помощью считывающего устройства для микропланшетов Enspire при 695 нм.
Измерение цитокинов Th2 / Th3
Уровни сывороточных IL-2, IL-4, IL-10 и TNF-α определялись соответствующими коммерческими наборами ELISA согласно протоколам производителя. Короче говоря, все реагенты перед использованием следует довести до комнатной температуры. Образцы сыворотки или стандартные образцы рабочего раствора добавляли в соответствующие лунки микропланшета для ELISA и объединяли со специфическим антителом.Затем в каждую лунку микропланшета последовательно добавляют биотинилированное детектирующее антитело и конъюгат авидин-пероксидаза хрена (HRP) и инкубируют. Свободные компоненты смываются. Раствор субстрата добавляют в каждую лунку и инкубируют. Фермент-субстратная реакция останавливается добавлением стоп-раствора. Оптическая плотность (OD) измеряется спектрофотометрически на длине волны 450 нм. Соотношение Th2 и Th3 рассчитывали по следующей формуле: Th2 / Th3 = (CIL-2 + CTNFα) / (CIL-4 + CIL10).
Анализ репродуктивного гормона
Сывороточные уровни эстрадиола, прогестерона и PGF2α в сыворотке были определены Пекинским Северным институтом биотехнологии, Ltd. с использованием соответствующих коммерческих наборов для анализа. Протокол обнаружения эстрадиола, прогестерона и PGF2α был аналогичен протоколу обнаружения TNF-α, как уже было показано в разделе «Измерение цитокинов Th2 / Th3».
Статистический анализ
Многомерный статистический анализ данных плазменных метаболитов
Необработанные данные МС были обработаны Progenesis QI (Nonlinear Dynamics, Ньюкасл, Великобритания) для фильтрации шума, корректировки базовой линии, выравнивания пиков, а также идентификации и количественной оценки пиков.Для выравнивания пиков применялись ошибки времени удерживания <0,1 мин. Пики ионов с пропущенными значениями> 50% в обеих группах были удалены из данных выравнивания. Затем нормализованные данные с автоматическим масштабированием были импортированы в программное обеспечение MetaboAnalyst онлайн (29) для выполнения многомерного и одномерного статистического анализа, а именно неконтролируемого анализа главных компонентов (PCA), контролируемого частичного дискриминантного анализа методом наименьших квадратов (PLS-DA), t -тест и анализ кратных изменений. Потенциальные биомаркеры были выбраны в соответствии с оценкой переменной важности в проекции (VIP)> 1 по модели PLS-DA.Потенциальные биомаркеры были дополнительно оптимизированы с помощью теста Стьюдента t на их численность у молочных коров с РП и здоровых молочных коров. Скорректированное значение p <0,05 считалось статистически значимым. Биомаркеры были дополнительно подвергнуты скринингу в соответствии с оценкой VIP> 1, скорректированным значением p <0,05 и кратным изменением> 2 или <0,5.
Статистический анализ данных BCS, возраста, биохимии сыворотки, маркеров окисления и антиоксидантов, цитокинов Th2 / Th3 и репродуктивных гормонов
BCS, возраст, биохимия сыворотки, маркеры окисления и антиоксиданты, цитокины Th2 / Th3 и данные репродуктивного гормона были проанализированы с помощью SAS 9.2 (SAS Institute Inc., Кэри, Северная Каролина, США). Различия BCS, возраста, биохимии сыворотки, маркеров окисления и антиоксидантов, цитокинов Th2 / Th3 и репродуктивного гормона между здоровой группой и группой RP сравнивали с помощью одностороннего дисперсионного анализа с тестом Тьюки.
Идентификация биомаркеров и анализ метаболических путей
Оптимизация кандидатных биомаркеров была выполнена путем сравнения точности значений m / z (<25 ppm), а спектры МС / МС были интерпретированы с использованием самостоятельно созданной базы данных метаболитов (Shanghai Applied Protein Technology Co., Ltd., Шанхай, Китай) на основе их подписей MS и MS / MS. Чтобы оценить рациональность кандидатных биомаркеров и интуитивно отобразить различия в паттернах экспрессии метаболитов-кандидатов в разных образцах, был проведен иерархический кластерный анализ на основе количества кандидатных биомаркеров. Кластерный и корреляционный анализ оптимизированных биомаркеров-кандидатов был выполнен с помощью R (версия 3.6.1). Метаболические пути, задействованные в оптимизированных биомаркерах-кандидатах, были идентифицированы базой данных Киотской энциклопедии генов и геномов (KEGG).
Результаты
Метаболические изменения у молочных коров с RP
В режимах положительных и отрицательных ионов, 4617 и 2897 пиков ионов метаболитов, соответственно, были идентифицированы в режимах положительных и отрицательных ионов, и в этих пиках ионов метаболитов было идентифицировано 3012 метаболитов. На сгенерированных графиках оценок PCA образцы между группами показали значительную тенденцию к разделению, а образцы внутри групп имели тенденцию группироваться в положительном и отрицательном режимах. Метаболические профили образцов плазмы здоровых и больных групп были четко разделены на отрицательный и положительный режимы.Эти данные свидетельствуют о том, что метаболический профиль плазмы у молочных коров с РП значительно отличался от такового у здоровых молочных коров (Рисунки 1A, B).
Рисунок 1 . Дифференциация метаболических профилей плазмы здоровых дойных коров и дойных коров с задержкой плаценты (RP). (A, B) Графики показателей анализа главных компонентов (PCA), основанные на метаболических профилях плазмы здоровых и больных групп в положительном и отрицательном режимах. ESI +: R 2 = 0.568, ESI–: R 2 = 0,603. (C, D) Графики оценки PLS-DA для здоровых и RP групп в положительном и отрицательном режимах. ESI +: R2X = 0,235, R2Y = 0,953, Q2 = 0,451; ESI–: R2X = 0,257, R2Y = 0,969, Q2 = 0,684. (E, F) Тест перестановки модели PLS-DA: ESI +: пересечения R 2 = 0,691 и Q2 = -0,154, ESI–: пересечения R 2 = 0,621 и Q2 = -0,348.
В модели PLS-DA, выборки групп с заболеванием и здоровых были четко разделены (рисунки 1C, D), и линии регрессии Q2, основанные на тесте перестановки с отрицательным пересечением, предполагали, что модель не переоснащалась (рисунки 1E). , F).В режимах положительной и отрицательной ионизации было 629 и 488 метаболитов соответственно с VIP> 1.
Дифференциальные метаболиты в плазме молочных коров с RP и здоровых коров были дополнительно исследованы с скорректированным значением p <0,05 и кратным изменением> 2. Было обнаружено 164 и 112 дифференциальных метаболитов с скорректированным значением p <0,05 и кратным изменением> 2 в режимах положительной и отрицательной ионизации (рис. 2).
Рисунок 2 .Кандидаты в биомаркеры в плазме здоровых дойных коров и дойных коров с РП. (A) Режим положительной ионизации электрораспылением (ESI +); (B) Режим отрицательной ионизации электрораспылением (ESI–).
Дифференциальные метаболиты были дополнительно оптимизированы с оценкой VIP> 1, скорректированным значением p <0,05 и кратным изменением> 2,0 в режимах положительной и отрицательной ионизации для скрининга потенциальных биомаркеров (таблица 1). В режимах положительной и отрицательной ионизации было обнаружено 18 и 6 биомаркеров-кандидатов.
Таблица 1 . Результат определения биомаркеров в плазме телят с РП.
Как показано на рисунке 3, образцы в группах сформировали кластеры, а образцы между группами были разделены в режимах положительной и отрицательной ионизации. Кандидаты в биомаркеры со схожими паттернами экспрессии в разных образцах были сгруппированы, что позволяет предположить, что эти кандидаты биомаркеры были расположены в более близком процессе реакции в метаболическом пути.
Рисунок 3 .Связь между здоровыми образцами и образцами RP, а также паттерны экспрессии потенциальных биомаркеров в разных образцах.
Как показывает анализ обогащения и анализ путей, показанный на рисунке 4, цикл мочевины, цикл глюкоза-аланин, рециркуляция аммиака, метаболизм аргинина и пролина, метаболизм глутамата и метаболизм аспартата значительно изменились у молочных коров с RP. Более того, эти измененные метаболические пути были взаимосвязаны. Эти данные свидетельствуют о том, что у этих коров были нарушены преобразование, использование и выделение азота.
Рисунок 4 . У молочных коров с РП нарушены пути преобразования, использования и выделения азота. (A) Обогащенный путь KEGG с участием кандидатов в биомаркеры. а: цитратный цикл; б: метаболизм аргинина и пролина; c: метаболизм порфирина и хлорофилла; d: метаболизм глиоксилата и дикарбоксилата; е: биосинтез аминоацил-тРНК; е: метаболизм аланина, аспартата и глутамата; г: азотный обмен; ч: валин, лейцин и изолейцин; l: биосинтез аргинина; m: D, -глутамин и D, -глутамат. (B) Схема сети путей обогащения с участием кандидатов в биомаркеры. Каждый узел представляет собой набор метаболитов, цвет которого зависит от кратности обогащения.
Пониженное соотношение цитокинов Th2 / Th3 у молочных коров с RP
Чтобы исследовать изменения иммунной функции дойных коров с RP, определяли сывороточные уровни IL-2, IL-4, IL-10 и TNF-α. Как показано в Таблице 2, уровни IL-2 и IL-4 в сыворотке молочных коров с RP были значительно ниже, чем у здоровых коров, в то время как уровни IL-10 и TNF-α увеличивались, а уровень Th2 / Th3 соотношение цитокинов было снижено.
Таблица 2 . Пониженное соотношение цитокинов Th2 / Th3, нарушение регуляции антиоксидантной способности и репродуктивных гормонов у дойных коров с РП (среднее ± стандартное отклонение).
Дисбаланс антиоксидантной способности у дойных коров с RP
Чтобы исследовать изменение антиоксидантной способности у дойных коров с РП, определяли уровень MDA и активность SOD и GSH-Px. Результаты представлены в таблице 2. Уровень MDA значительно увеличился в сыворотке молочных коров с RP по сравнению со здоровыми коровами.Активность SOD и GSH-Px была значительно снижена в сыворотке молочных коров с RP.
Нарушение регуляции T-биллионов, ЩФ и репродуктивных гормонов
Изменения в биохимии крови являются важными биомаркерами болезней. Поэтому оценивали биохимию крови дойных коров с РП. РПЖ была распространенным многофакторным послеродовым репродуктивным заболеванием, поэтому также оценивались репродуктивные гормоны. Как показано в Таблице 2 и Дополнительной Таблице 3, повышенные уровни T-bil, ALP и прогестерона и пониженные уровни эстрадиола и PGF2α были обнаружены в сыворотке молочных коров с RP.
Обсуждение
Чтобы изучить сложный патогенез RP, все большее количество исследований было сосредоточено на обнаружении потенциальных патологических факторов, вовлеченных в сложный патологический процесс у дойных коров с RP (30). Биохимические показатели крови являются важными маркерами физиологического или патологического состояния организма (31, 32). Таким образом, в настоящем исследовании было обнаружено несколько биохимических показателей. Уровни T-bil и ALP значительно увеличились у молочных коров с RP, а другие биохимические показатели (TP, ALB, GLB, ALT, AST, CK, BUN, CREA, GLU, TG и TC) не показали различий между здоровыми и здоровыми коровами. группы болезней.ЩФ поступает в основном из печени и также является маркером повреждения печени. Однако, поскольку не было различий в Alb, ALT и AST, жизненно важных маркерах повреждения печени, между здоровыми и больными группами, мы предположили, что повышение ALP у молочных коров с RP может быть связано с RP (33, 34).
Отделение и изгнание плаценты из материнской матки — это скоординированный, регулируемый мультисистемный и многофакторный процесс. Было продемонстрировано, что иммунный ответ играет жизненно важную роль в процессе отделения и отхождения плаценты (16, 26, 27).Во время перинатального периода клетки Th2 постепенно происходят из клеток Th3 и секретируют провоспалительные цитокины, чтобы инициировать воспалительный ответ, который вызывает апоптоз клеток трофобласта и эпителиальных клеток эндометрия и способствует отделению плаценты (27, 35–37). В настоящем исследовании соотношение цитокинов Th2 / Th3 было значительно снижено у дойных коров с RP, что могло снизить воспалительную реакцию в матке и вызвать задержку плаценты.
Более того, хорошо известно, что существует тесная взаимосвязь между степенью окисления и воспалением в процессе изгнания плодных оболочек (25, 26, 38).Окислительный стресс увеличивает риск задержки плаценты (39). Результат увеличения MDA и снижения активности GSH-Px и SOD соответствовал предыдущему сообщению (40). Баланс репродуктивных гормонов также важен для отделения и изгнания плаценты (39, 41, 42). В этом исследовании уровни эстрадиола, прогестерона и PGF2α в сыворотке молочных коров с РП были значительно ниже, чем у здоровых коров. Более низкий уровень эстрадиола и PGF2α может снизить сократимость матки, что приведет к невозможности изгнания плодных оболочек.
Несмотря на то, что были обнаружены несбалансированная антиоксидантная способность, пониженное соотношение цитокинов Th2 / Th3 и нарушение регуляции T-bil, ALP и репродуктивных гормонов, взаимосвязь этих биологических факторов и точный патогенез RP все еще неясны. Трудно прояснить сложный патологический процесс, связанный с РПЖ, вовлеченным в пищевую, метаболическую, иммунную, нервную и репродуктивную системы, используя только несколько показателей крови. Метаболиты организма также являются продуктами всесторонней регуляции множества систем.Обзор изменений метаболитов полезен для выявления диагностических маркеров и исследования патогенетических механизмов заболевания. Метаболомика может быстро, чутко и всесторонне отслеживать изменения метаболитов организма при физиологических или патологических состояниях (18, 20).
В настоящем исследовании метаболомика плазмы была обнаружена с помощью сверхвысокопроизводительной жидкостной хроматографии-квадрупольной времяпролетной масс-спектрометрии (UPLC-Q-TOF / MS) для выявления потенциальных биомаркеров и патогенеза RP у дойных коров.Результаты показывают, что метаболический профиль значительно изменяется у дойных коров с РП. Кроме того, были обнаружены 23 потенциальных биомаркера, которые в основном участвовали в цикле мочевины, глюкозно-аланиновом цикле, рециркуляции аммиака, метаболизме аргинина и пролина, метаболизме глутамата и метаболизме аспартата. L -аргинин, L -лизин, L -лейцин и L -аланин, которые были потенциальными биомаркерами, в сыворотке молочных коров с RP были значительно ниже, чем у здоровых коров.В нескольких предыдущих исследованиях сообщалось о значительных различиях в различных аминокислотах, а именно лейцине и аргинине, между здоровыми дойными коровами и дойными коровами с RP, но в различных отчетах об исследованиях эти аминокислоты не имели последовательной тенденции изменения (43–45 ). Например, в нескольких исследованиях метаболомикой было обнаружено значительное снижение различных аминокислот в плазме дойных коров с РП, и соответствующие результаты настоящего исследования согласуются с этим. Однако в других исследованиях соответствующие аминокислоты показали противоположные результаты.Некоторые исследователи полагают, что противоположные результаты могут быть связаны с различным течением болезни, но единого мнения еще не сформировано, и необходимы дальнейшие исследования. Сообщалось, что аргинин не только участвует в синтезе белка, мочевины и пиримидина, но также влияет на высвобождение различных эндокринных гормонов, таких как инсулин и гормон роста (46, 47). Более того, L -аргинин может регулировать иммунную функцию и эстроген с помощью пути NO (48, 49).Дефицит лизина также может вызывать иммунодефицит (50). Снижение уровня аланина в плазме является признаком дефицита аминокислот с разветвленной цепью (BCAA) (51).
В этом исследовании L -лейцин, тип BCAA, имел ту же тенденцию изменения, что и L -аланин. Было документально подтверждено, что дефицит BCAA может вызывать дисфункцию иммунных клеток (52). В этом исследовании мы предположили, что снижение уровня L, -аргинина, L, -лизина, L, -лейцина и L, -аланина, были ответственны за несбалансированную антиоксидантную способность, снижение соотношения цитокинов Th2 / Th3 и дерегуляцию репродуктивной функции. гормоны.Лизофосфатидилхолины (LysoPCs), а именно LysoPC (16: 0), LysoPC (22: 6), LysoPC (20: 3), LysoPC (20: 5), LysoPC (20: 4), LysoPC (20: 2), LysoPC (18: 2), LysoPC (18: 3) и LysoPC (20: 4) в сыворотке молочных коров с RP были значительно ниже, чем у здоровых коров. Предыдущие исследования также показали более низкие концентрации LysoPC (18: 2), LysoPC (20: 3), LysoPC (20: 4), LysoPC (28: 0) и LysoPC (28: 1) у коров с RP, чем у здоровых коров ( 43, 45). Хотя LysoPC является основным компонентом липидов в крови, его физиологическая роль все еще неясна (53).Сообщалось, что LysoPC играет роль в иммуномодуляции, антигемостазе и цитотоксичности. Насыщенный LysoPC (LysoPC 16: 0 и 18: 0) и мононенасыщенный LysoPC (18: 1) могут вызывать воспалительные процессы, такие как высвобождение хемотаксических факторов и усиленное производство активных форм кислорода (ROS) (53, 54).
Мы предположили, что более низкий уровень LysoPC снижает воспалительную реакцию в процессе изгнания плаценты, что согласуется с вышеизложенными результатами о том, что соотношение цитокинов Th2 / Th3 было значительно снижено у молочных коров с RP.Повышенные потенциальные биомаркеры, а именно L, -глутамат, цитрат, цис-аконитат, билирубин, 8/9-DiHETrE, биливердин и фенилацетилглицин, были обнаружены у молочных коров с RP. Более того, 8,9-DiHETrE является важным аутокринным и паракринным фактором, который выполняет разнообразные биологические функции, такие как регуляция сосудистого тонуса, почечный канальцевый транспорт и воспаление. Билирубин и биливердин имеют те же тенденции изменения, что и T-bil, что позволяет предположить, что метаболизм билирубина нарушен у дойных коров с RP.Предыдущее исследование метаболомики у дойных коров с RP также показало, что уровень глутамата значительно повышался при различных курсах RP (43). Повышенный уровень L, -глутамата, цитрата и цис-аконитата можно отнести к глутаминолизу. Глутаминолиз состоит из серии биохимических реакций, которые катаболизируют глутамин до глутамата, цитрата, аспартата, пирувата и лактата. В настоящем исследовании мы предположили, что глутаминолиз был значительно усилен у дойных коров с РП.Результат анализа обогащения пути KEGG, основанный на этих потенциальных биомаркерах, показал, что задействованные метаболические пути взаимосвязаны, и у молочных коров с RP нарушены конверсия, использование и выведение азота. Таким образом, мы считали, что регуляция метаболических путей, вовлеченных в эти потенциальные биомаркеры, может быть многообещающей терапевтической стратегией для RP, а также быть полезной для разработки патологического механизма RP. Однако, так как образцы не собирались до появления RP, это исследование имело определенные ограничения: можно ли использовать эти потенциальные биомаркеры в качестве потенциальных диагностических биомаркеров для раннего предупреждения дойных коров с RP.
Таким образом, в плазме молочных коров с РП были обнаружены 23 потенциальных биомаркера. Метаболические пути, вовлеченные в эти потенциальные биомаркеры, были взаимосвязаны, и у этих коров были нарушены конверсия, использование и выведение азота. Более того, дисбаланс этих потенциальных биомаркеров может быть ответственным за несбалансированный антиоксидантный потенциал, снижение соотношения цитокинов Th2 / Th3 и нарушение регуляции репродуктивных гормонов у этих коров (Рисунок 5). Регулирование метаболических путей, участвующих в этих потенциальных биомаркерах, является многообещающей терапевтической стратегией при РП.
Рисунок 5 . Дисбаланс потенциальных биомаркеров может быть причиной несбалансированной антиоксидантной способности, снижения соотношения цитокинов Th2 / Th3 и нарушения регуляции репродуктивных гормонов у дойных коров с RP.
Заявление о доступности данныхИсходные материалы, представленные в исследовании, включены в статью / дополнительные материалы, дальнейшие запросы можно направлять соответствующим авторам.
Заявление об этикеИсследование на животных было рассмотрено и одобрено Комитетом по уходу и использованию животных Института животноводства и фармацевтических наук Ланьчжоу Китайской академии сельскохозяйственных наук (Ланьчжоу, Китай).Письменное информированное согласие было получено от владельцев на участие их животных в этом исследовании.
Авторские взносы
YL и DC: привлечение финансирования и методология. ZZ: управление проектами и визуализация. YY, XL и LW: администрирование проекта. ПО: ресурсы. MH: концептуализация, методология, формальный анализ и написание — первоначальный проект. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
Эта работа финансировалась Программой ключевых исследований и разработок Нинся-Хуэйского автономного района (2019BEF02003), ключевыми проектами исследований и разработок в провинции Ганьсу (20YF3NA003), Независимым инновационным фондом сельскохозяйственных технологий автономного района Нинся-Хуэй 14-й пятилетний план Сельское хозяйство High- Демонстрационный проект инновационных технологий развития качества и защиты окружающей среды (NGSB-2021-12-06), расходы на фундаментальные научные исследования научно-исследовательских институтов Центрального общественного благосостояния (1610322020012) и Фонд стартапов докторских исследований дочерней больницы Юго-Западного медицинского университета (19063) .
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Примечание издателя
Все утверждения, выраженные в этой статье, принадлежат исключительно авторам и не обязательно отражают претензии их дочерних организаций или издателей, редакторов и рецензентов. Любой продукт, который может быть оценен в этой статье, или заявление, которое может быть сделано его производителем, не подлежат гарантии или одобрению со стороны издателя.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fvets.2021.697789/full#supplementary-material
Список литературы
1. Бенедиктус Л., Коэтс А.П., Куиджперс Ф.Х., Йустен И., ван Элдик П., Хеувен Х.С. Наследственные и ненаследственные генетические эффекты на задержанную плаценту у крупного рогатого скота Мёз-Рейн-Исель. Anim Reprod Sci. (2013) 137: 1–7. DOI: 10.1016 / j.anireprosci.2012.12.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Моретти П., Пробо М., Моранди Н., Тревизи Е., Феррари А., Минути А. и др. Гематологические изменения в раннем послеродовом периоде у молочных коров голштинской породы с задержкой плаценты. Anim Reprod Sci. (2015) 152: 17–25. DOI: 10.1016 / j.anireprosci.2014.11.019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Махнани А., Садеги-Сефидмазги А., Ансари-Махьяри С., Горбани Г.Р., Кешаварзи Х.Факторы фермы и коровы и их взаимодействие на частоту задержки плаценты у коров голштинской породы. Териогенология. (2021) 159: 87–97. DOI: 10.1016 / j.theriogenology.2020.10.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Зобель Р., Ткалчич С. Эффективность озона и других методов лечения задержанной плаценты у дойных коров. Reprod Domest Anim. (2013) 48: 121–5. DOI: 10.1111 / j.1439-0531.2012.02041.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6.Ку Й., Фадден А. Н., Трабер М. Г., Бобе Г. Индикаторы потенциального риска задержки плаценты и других заболеваний у повторнородящих коров. J Dairy Sci. (2014) 97: 4151–65. DOI: 10.3168 / jds.2013-7154
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Dubuc J, Denis-Robichaud J. Исследование послеродовых заболеваний на уровне молочного стада и их связи с репродуктивной функцией и выбраковкой. J Dairy Sci. (2017) 100: 3068–78. DOI: 10.3168 / jds.2016-12144
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8.Хан И.К., Ким И.Х. Факторы риска задержанной плаценты и влияние задержанной плаценты на возникновение послеродовых заболеваний и последующую репродуктивную способность дойных коров. J Vet Sci. (2005) 6: 53–9. DOI: 10.4142 / jvs.2005.6.1.53
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Эйлер Х., Хопкинс Ф.М. Успешное лечение задержанной плаценты с помощью инъекций коллагеназы в пуповину коров. J Am Vet Med Assoc. (1993) 203: 436–43.
PubMed Аннотация | Google Scholar
10. Стивенс Р.Д., Динсмор Р.П. Обработка дойных коров во время родов простагландином F2 альфа или окситоцином для предотвращения задержки плодных оболочек. J Am Vet Med Assoc. (1997) 211: 1280–4.
PubMed Аннотация | Google Scholar
11. Лю В.Б., Чуанг С.Т., Шю К.Л., Чанг С.К., Джек А., Пэ Х.С. и др. Стратегия лечения послеродового метрита и повышения репродуктивной способности коров с задержкой плаценты. Acta Vet Hung. (2011) 59: 247–56. DOI: 10.1556 / avet.2011.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Имхоф С., Лютернауэр М., Хюслер Дж., Штайнер А., Хирсбруннер Г. Терапия задержанных плодных оболочек у крупного рогатого скота: сравнение двух протоколов лечения. Anim Reprod Sci. (2019) 206: 11–6. DOI: 10.1016 / j.anireprosci.2019.04.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Кимура К., Гофф Дж. П., Керли М.Э. младший, Рейнхардт Т.А.Снижение функции нейтрофилов как причина задержки плаценты у молочного скота. J Dairy Sci. (2002) 85: 544–50. DOI: 10.3168 / jds.S0022-0302 (02) 74107-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Дервиши Э., Чжан Дж., Хайлемариам Д., Данн С.М., Аметадж Б.Н. Возникновению задержки плаценты предшествует воспалительное состояние и изменения энергетического обмена у коров переходного периода. J Anim Sci Biotechnol. (2016) 7:26. DOI: 10.1186 / s40104-016-0085-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15.Симидзу Т., Морино И., Китаока Р., Миямото А., Кавасима С., Ханеда С. и др. Изменения количества лейкоцитов и экспрессии про- и противовоспалительных цитокинов в периферических лейкоцитах у дойных коров с сохраненными плодными оболочками . (2018) 89: 1371–8. DOI: 10.1111 / asj.13065
CrossRef Полный текст | Google Scholar
16. Эспозито Г., Айронс П.С., Уэбб Е.К., Чапваня А. Взаимодействие между отрицательным энергетическим балансом, метаболическими заболеваниями, здоровьем матки и иммунным ответом у молочных коров переходного периода. Anim Reprod Sci. (2014) 144: 60–71. DOI: 10.1016 / j.anireprosci.2013.11.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Лу В., Сун Х, Сюй М., Ло И, Джин Дж, Шао Х и др. Азот мочевины крови может служить прогностическим индикатором задержки плаценты у дойных коров. Anim Reprod Sci. (2020) 218: 106481. DOI: 10.1016 / j.anireprosci.2020.106481
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. de Seymour JV, Conlon CA, Sulek K, Villas Boas SG, McCowan LM, Kenny LC, et al.Профилирование метаболитов на ранних сроках беременности позволяет выявить потенциальный биомаркер последующего развития гестационного сахарного диабета. Acta Diabetol. (2014) 51: 887–90. DOI: 10.1007 / s00592-014-0626-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Пингили А.К., Кара М., Хан Н.С., Эстес А.М., Лин З., Ли В. и др. 6бета-гидрокситестостерон, метаболит тестостерона цитохрома P450 1B1, способствует гипертензии, индуцированной ангиотензином II, и ее патогенезу у самцов мышей. Гипертония. (2015) 65: 1279–87. DOI: 10.1161 / HYPERTENSIONAHA.115.05396
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Ван Л., Ко Э. Р., Гилкрист Дж. Дж., Питтман К. Дж., Раутанен А., Пиринен М. и др. Генетические вариации и метаболиты человека показывают, что метилтиоаденозин является прогностическим биомаркером и воспалительным регулятором при сепсисе. Sci Adv. (2017) 3: e1602096. DOI: 10.1126 / sciadv.1602096
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24.Гонсалес-Домингес Р., Саяго А., Фернандес-Рекамалес А. Высокопроизводительная метаболомика на основе прямой масс-спектрометрии для характеристики отпечатков пальцев метаболитов, связанных с патогенезом болезни Альцгеймера. Метаболиты. (2018) 8:52. DOI: 10.3390 / metabo8030052
CrossRef Полный текст | Google Scholar
25. Эндлер М., Сальтведт С., Эвейда М., Океруд Х. Окислительный стресс и воспаление в задержанной плаценте: пилотное исследование экспрессии белков и генов GPX1 и NFκB. BMC Беременность и роды. (2016) 16: 384. DOI: 10.1186 / s12884-016-1135-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Язлик М.О., Чолакоглу Х.Э., Пеккан М., Кая У., Качар К. Вурал М.Р. и др. Оценка активности супероксиддисмутазы, функции нейтрофилов и метаболического профиля у коров с задержкой плаценты. Териогенология. (2019) 128: 40–6. DOI: 10.1016 / j.theriogenology.2019.01.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27.Прабхудас М., Бонни Э., Карон К., Дей С., Эрлебахер А., Фазлеабас А. и др. Иммунные механизмы на стыке матери и плода: перспективы и проблемы. Nat Immunol. (2015) 16: 328–34. DOI: 10.1038 / ni.3131
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Эдмонсон А.Дж., Лин И.Дж., Уивер Л.Д., Фарвер Т., Вебстер Г. Таблица оценки физического состояния коров голштинской породы. J Dairy Sci. (1989) 72: 68–78. DOI: 10.3168 / jds.S0022-0302 (89) 79081-0
CrossRef Полный текст | Google Scholar
29.Панг З., Чонг Дж., Чжоу Дж., Де Лима Мораис Д.А., Чанг Л., Барретт М. и др. MetaboAnalyst 5.0: сокращение разрыва между необработанными спектрами и функциональными знаниями. Nucleic Acids Res. (2021) 49: W388–96. DOI: 10.1093 / nar / gkab382
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Cruvinel LB, Ayres H, Zapa DMB, Nicaretta JE, Couto LFM, Heller LM, et al. Факторы распространенности и риска возбудителей диареи (коронавирус, ротавирус, Cryptosporidium spp., Eimeria spp., и нематоды-гельминты) в зависимости от возраста у молочных телят из Бразилии. Trop Anim Health Prod. (2019) 52: 777–91 DOI: 10.1007 / s11250-019-02069-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Quiroz-Rocha GF, LeBlanc S, Duffield T, Wood D, Leslie KE, Jacobs RM. Оценка предродовой концентрации холестерина и жирных кислот в сыворотке как предикторов послеродовой задержки плаценты у дойных коров. J Am Vet Med Assoc. (2009) 234: 790–3.DOI: 10.2460 / javma.234.6.790
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Молеф К., Мванза М. Биохимия сыворотки у коров разных пород с репродуктивными условиями. Onderstepoort J Vet Res. (2019) 86: e1 – e7. DOI: 10.4102 / ojvr.v86i1.1742
CrossRef Полный текст | Google Scholar
33. Гол М., Сисман А.Р., Гуклу С., Алтунюрт С., Онвурал Б., Демир Н. Пол плода влияет на общий уровень сывороточной и плацентарной щелочной фосфатазы во время беременности. евро J Obstet Gynecol Reprod Biol. (2006) 128: 253–6. DOI: 10.1016 / j.ejogrb.2005.10.034
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Ферианец В., Лингартова Л. Чрезвычайное повышение уровня плацентарной щелочной фосфатазы как маркера преждевременных родов, плацентарной недостаточности и низкой массы тела при рождении. Neuro Endocrinol Lett. (2011) 32: 154–7.
PubMed Аннотация | Google Scholar
35. Норман Дж. Э., Боллапрагада С., Юань М., Нельсон С. М..Воспалительные пути в механизме родов. BMC Беременность и роды. (2007) 7 (Приложение 1): S7. DOI: 10.1186 / 1471-2393-7-S1-S7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Боро П., Кумаресан А., Сингх А.К., Гупта Д., Кумар С., Манимаран А. и др. Экспрессия рецепторов короткоцепочечных жирных кислот и провоспалительных цитокинов в тканях матки и плаценты изменяется у коров, у которых развивается задержка плодных оболочек. Плацента. (2014) 35: 455–60.DOI: 10.1016 / j.placenta.2014.04.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Боро П., Кумаресан А., Патхак Р., Патбандха Т.К., Кумари С., Ядав А. и др. Изменение концентрации некоторых провоспалительных цитокинов в периферической крови у коров, вызывающее задержку плодных оболочек. Anim Reprod Sci. (2015) 157: 11–6. DOI: 10.1016 / j.anireprosci.2015.02.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38.Леблан С.Дж., Хердт Т.Х., Сеймур В.М., Даффилд Т.Ф., Лесли К.Э. Витамин Е, ретинол и бета-каротин в сыворотке крови молочного скота в послеродовой период и их связь с болезнями. J Dairy Sci. (2004) 87: 609–19. DOI: 10.3168 / jds.S0022-0302 (04) 73203-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. McNaughton AP, Murray RD. Структура и функция материнского плода крупного рогатого скота по отношению к причинам задержания плодных оболочек. Vet Rec. (2009) 165: 615–22.DOI: 10.1136 / vr.165.21.615
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Канкофер М. Механизмы антиоксидантной защиты против активных форм кислорода в удерживаемой и не удерживаемой плаценте крупного рогатого скота: активность глутатионпероксидазы, глутатионтрансферазы, каталазы и супероксиддисмутазы. Плацента. (2001) 22: 466–72. DOI: 10.1053 / plac.2001.0650
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Вишрал А., Нишияма-Наруке А., Кури Р., Барнабе Р.С.Концентрации в плазме эстрадиола 17beta и метаболита PGF2alpha, состав жирных кислот плаценты и активность антиоксидантных ферментов у коров с сохраненными плодными оболочками и без них. Простагландины Other Lipid Mediat. (2001) 65: 117–24. DOI: 10.1016 / S0090-6980 (01) 00123-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Wischral A Verreschi IT Lima SB Hayashi LF Barnabe RC. Предоточный профиль стероидов и простагландинов у коров с ретенцией плодных оболочек или без нее. Anim Reprod Sci. (2001) 67: 181–8. DOI: 10.1016 / S0378-4320 (01) 00119-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Хайлемариам Д., Мандал Р., Салим Ф., Данн С., Вишарт Д., Аметадж Б. Метаболомический подход выявляет измененные профили аминокислот и сфинголипидов в плазме, связанные с патологическим состоянием у молочных коров переходного периода. Curr Metabol. (2014) 2: 184–95. DOI: 10.2174 / 2213235X03666141216201446
CrossRef Полный текст | Google Scholar
44.Хайлемариам Д., Мандал Р., Салим Ф., Данн С.М., Вишарт Д.С., Аметадж Б.Н. Выявление прогностических биомаркеров болезненного состояния у молочных коров переходного периода. J Dairy Sci. (2014) 97: 2680–93. DOI: 10.3168 / jds.2013-6803
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Дервиши Э., Чжан Дж., Мандал Р., Вишарт Д.С., Аметадж Б.Н. Направленная метаболомика: новое понимание патобиологии задержанной плаценты у дойных коров и биомаркеров потенциального риска. Животное. (2018) 12: 1050–9. DOI: 10.1017 / S1751731117002506
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Malaisse WJ, Blachier F, Mourtada A, Camara J, Albor A, Valverde I, et al. Связь стимул-секреция высвобождения инсулина, индуцированного аргинином. Метаболизм L-аргинина и L-орнитина в островках поджелудочной железы. Biochim Biophys Acta. (1989) 1013: 133–43. DOI: 10.1016 / 0167-4889 (89)
-4PubMed Аннотация | CrossRef Полный текст | Google Scholar
47.Педринелли Р., Эбель М., Катапано Дж., Делл’Омо Дж., Дуччи М., Дель Чикка М. и др. Прессорные, почечные и эндокринные эффекты L-аргинина при гипертонической болезни. Eur J Clin Pharmacol. (1995) 48: 195–201. DOI: 10.1007 / BF00198298
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Jankowski J, Mikulski D, Mikulska M, Ognik K, Całyniuk Z, Mróz E, et al. Влияние различных соотношений аргинина, метионина и лизина в рационе на продуктивность, характеристики туши и иммунный статус индеек. Poult Sci. (2020) 99: 1028–37. DOI: 10.1016 / j.psj.2019.10.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Палмер Т.Н., Калдекорт Массачусетс, Снелл К., Сагден М.С. Аланин и межорганные взаимоотношения в метаболизме разветвленных аминов и 2-оксокислот. Rev Biosci Rep. (1985) 5: 1015–33. DOI: 10.1007 / BF01119623
CrossRef Полный текст | Google Scholar
52. Nie CX, He T, Zhang WJ, Zhang GL, Ma X. Аминокислоты с разветвленной цепью: за пределами пищевого метаболизма. Int J Mol Sci. (2018) 19: 954. DOI: 10.3390 / ijms1
54
CrossRef Полный текст | Google Scholar
54. Племель Дж. Р., Майклс Н. Дж., Вейсхаупт Н., Капрариелло А. В., Кио МБ, Роджерс Дж. А. и др. Механизмы демиелинизации, вызванной лизофосфатидилхолином: первичная липидоразрушающая миелинопатия. Glia. (2018) 66: 327–47. DOI: 10.1002 / glia.23245
PubMed Аннотация | CrossRef Полный текст | Google Scholar
.


 В основе этого негормонального препарата — пропранолола гидрохлорид, действие которого направлено на усиление сокращений гладкой мускулатуры матки. Для профилактики задержания последа Утеротон вводят при родах, однократно внутримышечно или внутривенно в дозе 10мл на животное. При обнаружении симптомов задержания последа необходимо внутримышечно или внутривенно ввести лекарство: 3 раза по 10 мл с 12-часовым интервалом. Функциональная активность матки повышается в 2,5–3,3 раза. Плодные оболочки, как правило, отходят в течение 1–4 часов.
В основе этого негормонального препарата — пропранолола гидрохлорид, действие которого направлено на усиление сокращений гладкой мускулатуры матки. Для профилактики задержания последа Утеротон вводят при родах, однократно внутримышечно или внутривенно в дозе 10мл на животное. При обнаружении симптомов задержания последа необходимо внутримышечно или внутривенно ввести лекарство: 3 раза по 10 мл с 12-часовым интервалом. Функциональная активность матки повышается в 2,5–3,3 раза. Плодные оболочки, как правило, отходят в течение 1–4 часов.


