Класс Нематоды — урок. Биология, Животные (7 класс).
Нематоды (от греч. немас — «нить») — это класс Круглых червей (около \(20\) тыс. видов). Среди нематод много паразитов. Это паразиты человека — аскарида, острица, власоглав, трихинелла. Есть виды, развивающиеся в растениях и питающиеся за их счёт. Картофельная, луковая, земляничная нематоды наносят большой вред культурным растениям. Известны также паразиты животных.
Но большинство нематод — микроскопические свободноживущие черви, обитающие на дне водоёмов или в почве. Они питаются разлагающимися остатками и бактериями. Есть среди нематод и хищники.
Кожно-мускульный мешок и первичная полость тела
Тело нематод веретенообразное: оно сужено к переднему и заднему концам.
Под плотной упругой оболочкой — кутикулой — залегает слой эпителиальных клеток. Ниже расположены продольные мышцы — четыре однослойные ленты. Такое строение позволяет круглым червям ползать, изгибая тело. Кутикула, эпителиальные клетки и мышцы образуют кожно-мускульный мешок.
Кутикула, эпителиальные клетки и мышцы образуют кожно-мускульный мешок.
Между кожно-мускульным мешком и кишечником находится первичная полость тела. Она заполнена жидкостью, которая за счёт давления поддерживает постоянную форму тела, способствует распределению по телу животного питательных веществ, перемещению продуктов распада к органам выделения.
Пищеварительная система
В отличие от ресничных червей и сосальщиков у нематод имеется анальное отверстие, а кишечник имеет вид прямой трубки, проходящей через всё тело.
На передней конце тела располагается рот, окружённый тремя губами. Ротовая полость переходит в мускулистую глотку. Из глотки пища попадает в среднюю кишку, где происходит её переваривание и всасывание образовавшихся продуктов. Непереваренные остатки выбрасываются через анальное отверстие.
Свободноживущие нематоды питаются органическими остатками и бактериями, паразитические виды получают питательные вещества из тела хозяина. Есть среди нематод и хищники. У некоторых видов в глотке расположены зубы, образованные выростами кутикулы.
Есть среди нематод и хищники. У некоторых видов в глотке расположены зубы, образованные выростами кутикулы.
Газообмен и обмен веществ
Свободноживущие нематоды дышат через поверхность тела.
Паразитические виды обходятся без кислорода. Необходимую для жизни энергию они получают за счёт расщепления гликогена — запасного органического вещества.
В связи с отсутствием кровеносной системы питательные вещества и продукты распада в организме переносятся жидкостью, которая заполняет полость тела.
Выделительная система
Выделительная система образована двумя боковыми слепо замкнутыми каналами и выделительным отверстием, расположенным в передней части тела. Стенки каналов образованы одной или несколькими очень длинными клетками (их длина может достигать \(40\) см). Образовавшиеся в организме вредные вещества поступают в полостную жидкость, затем — в каналы выделительной системы, и выводятся наружу.
Нервная система
Нервная система нематод представлена окологлоточным нервным кольцом и продольными нервными стволами — системой стволового типа.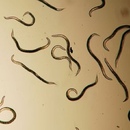
Органы чувств у круглых червей, особенно у паразитических видов, развиты очень слабо. На переднем конце тела у них имеются щетинки, воспринимающие прикосновение, и обонятельные ямки. Могут быть также слаборазвитые глаза.
Круглые черви относятся к раздельнополым животным. Органы размножения у самок представлены двумя яичниками, двумя яйцеводами, маткой и половым отверстием. У самцов есть семенник и семяпровод.
Источники:
http://biolgra.ucoz.ru/board/biznes_sotrudnichestvo/delovye_predlozhenija/16
Нематода на участке — кто это и как с ней бороться? Фото — Ботаничка.ru
Раньше считалось, что если на участке завелась нематода, то его можно смело бросать, продавать, строить на нем дом или прокладывать по этому участку дорогу. Люди не знали, как избавиться от нематоды, и ждали годами ее смерти от голода, прежде чем засеять растениями участок, который ранее был заражен нематодой. Занести нематоду проще простого и незачем описывать всевозможные способы: достаточно, например, купить розу с комом земли, и нематода уже на вашем участке, точка. А вот, как с ней бороться? Об этом мы расскажем в статье.
Занести нематоду проще простого и незачем описывать всевозможные способы: достаточно, например, купить розу с комом земли, и нематода уже на вашем участке, точка. А вот, как с ней бороться? Об этом мы расскажем в статье.
Содержание:
Биология нематоды
Нематоды – это, по одним классификациям, своеобразные круглые черви, а по другим — брюхоресничные черви. Видов этих тварей описано более трех десятков тысяч, однако, скорее всего, их куда больше. Подавляющие виды нематод являются паразитами самых разных растений, они также могут преспокойно жить в организмах рыб, человека и животных. Нематоды далеко не безобидные существа, у человека, животных и растений они вызывают самые различные болезни.
Длина тельца нематоды может сильно варьировать (от 80 микрон до нескольких метров, если иметь в виду отдельные виды паразитов). У нематод специфическая веретеновидная форма, суженая на концах. Тело в поперечнике круглое.
Здесь мы поговорим о нематодах, паразитирующих на растениях, и попробуем в свете современной науки побороться с ними настолько быстро, чтобы уже в следующем после заражения сезоне на участке можно было что-то посадить или посеять.
Начнем с разновидностей нематод, которые досаждают растениям. Обычно понять, что ваш участок заражен нематодой, очень сложно, признаков проявления именно ее активности мало. Например, вы видите, что всходы замедлены в развитии или почти нет роста и развития саженцев, или цветение слабое, или гибель растений в юном возрасте подозрительно значительная, или массово погибает урожай.
Все это может быть как признаком нематоды, так и признаком иных болезней или вредителей. Причина нездоровья растений может быть и в простой нехватке какого-то одного или группы элементов в почве. Поэтому, если и на следующий год наблюдается ровно такая же картина, то советуем взять пробу почвы, копнув лопатой в пакет и отнести в лабораторию, там вам скажут, нематода это или что-то иное, иначе вы так и будете лечить растения то от одного, то от другого, не получая должного эффекта и просто массово размножая злейшего врага.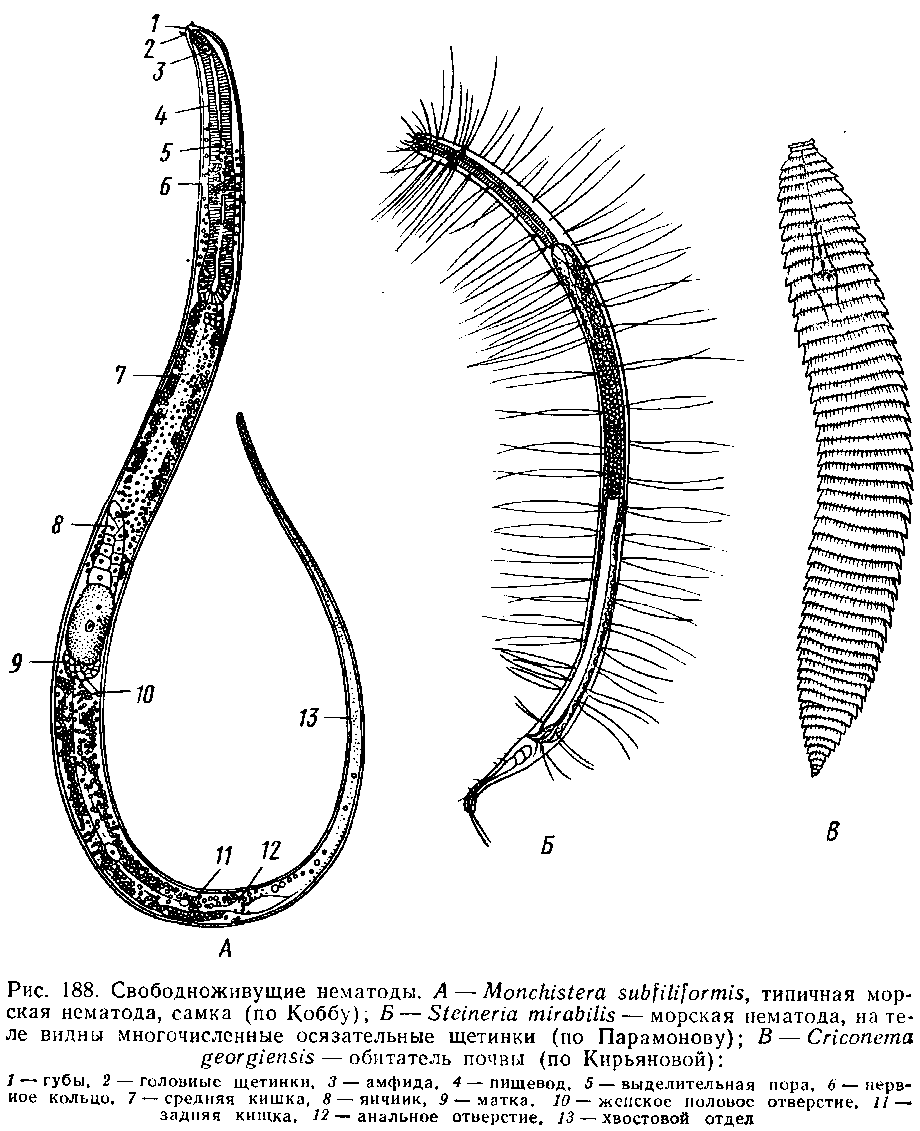
Чем опасна нематода?
В процессе своей активной жизнедеятельности она проникает в корни или вегетативную массу, нарушает целостность растения, вызывает гнили, заражение корней и вегетативной массы вирусами, грибной инфекцией, бактериями.
Понять, что нематода атаковала корни в принципе можно, если начавшее хиреть растение выдернуть из почвы целиком и тщательно осмотреть его корневую систему. При заражении нематодой вы можете увидеть большое количество разветвлений на корнях, растение словно пыталось найти пути обхода, избавляясь от вредителя.
При этом самые мелкие корешки, скорее всего, будут выглядеть отгнившими. Кроме того, на корнях, если это не бобовые культуры, можно видеть галлы, это буквально скопления нематод, цисты с яйцами, а также заострения и вздутия, разного рода язвы – все это смертельно опасно и для корня, и для всего растения в целом.
Подробнее о корневой нематоде
Итак, корневая нематода это, по сути, нитчатый червь, принадлежащий к весьма обширной группе червей-паразитов и классу нематод, которые образуют на корнях растений галлы, чем-то похожие на такие же у бобовых культур (только в таких галлах не клубеньковые бактерии, а самки, забитые яйцами).
Самцы корневой нематоды имеют вид червячка длиной до двух миллиметров, самки более раздутые (галлы) или похожие на кубышки, вполовину меньше длиной.
Земляная нематода удивительно многоядна: достоверно известно, что она может поражать корневую систему более чем двух тысяч видов растений. Конечно же, в эту группу включены культурные овощные растения, различные ценные технические культуры, а также декоративные растения, травы, кустарники и даже деревья.
Свое полное развитие до настоящего активного организма она проходит в зависимости от температуры в почве в течение 20-50 суток (когда теплее, то развитие проходит, как правило, быстрее). Примечательно, что самка нематоды за свою жизнь может отложить чудовищное количество яиц – до двух тысяч, а по последним сведениям — и более.
В каждом яйце личинка нематоды сначала проходит линьку, потом выходит на поверхность и, благодаря заострениям на концах, сразу проникает в корень близлежащего растения, начиная усиленно питаться соком этой культуры.
Наиболее активно растут и развиваются нематоды при умеренной влажности почвы (около 70-75%) и температуре от +22 до +28°С. Что касается кислотно-щелочного баланса, то они предпочитают чуть слабокислую почву, но не щелочную.
Корневая нематода у томатов. © Scot NelsonНематоды стеблевые и листовые
Помимо почвенных существуют также нематоды листовые и стеблевые. Чаще всего они приводят к веретеновидному утолщению стеблей, при этом листья либо недоразвиваются до нормальных размеров и формы, либо происходит сильная деформация листовых пластинок у самых разных растений.
Обычно более точным доказательством присутствия нематоды на листьях являются сухие некротические пятна различной формы, не имеющей никакой закономерности в расположении. Чаще всего листовыми нематодами бывают заражены: садовая земляника, хризантема и нефролепсис.
Рассмотрим типы нематод по самым важным культурам, и первой в этом списке будет у нас стоять столовая свекла
Нематода столовой свеклы
Интересно, что раньше официально не признавали наличие нематоды на свекле и почему-то болезнь именовали свекловичным утомлением: якобы при выращивании на одном и том же месте даже внесение удобрений не помогало получить хорошие результаты. Но потом все узнали, что и на свекле нематода также бывает, и свирепствует она весьма сильно.
Понять, что свекла заражена нематодой, на самом деле, довольно просто, для начала можно увидеть хорошо заметное побурение ее листьев, а если выдернуть такое растение, то можно увидеть или сгнивший наполовину (или чуть меньше) корнеплод, который остается только выбросить, потому что пускать в переработку его нельзя. Нередко корнеплоды могут быть целыми, но сильно теряют в весе в несколько раз, и абсолютно не хранятся, они могут быть использованы только для переработки.
Нематода на картофеле
Еще один овощ, который чаще всего поражает нематода — это картофель. Заразить свой участок этой напастью можно крайне легко, достаточно лишь раз купить семенной материал в непроверенном месте и на хорошем урожае можно на долгие годы ставить крест (или начать применять жесткую химию). Дело в том, что даже если вы разрежете купленный клубень, то можете совсем не заметить личинку, притаившуюся в картофелине, и лишь после ее помещения в почву она в виде червя выберется наружу.
Нематода картофеля — это круглый червь, достигающий примерно миллиметра длины, который может паразитировать как на корнях, так и на клубнях картофеля. Обычно в клубень из корней черви перебираются, если почва бедна питанием и корни очень тонкие.
Сам процесс жизнедеятельности картофельной нематоды весьма интересен. После выхода червей из клубня самки прикрепляются к концу корня и ждут самца, а самец в поисках самки может двигаться по корням картофеля, причиняя вред растению, и когда находит самку, то после ее оплодотворения погибает. Самка после этого фактически тоже гибнет, она превращается в кокон–цисту, в которой до тысячи особей разного пола находятся в виде яиц, они, естественно, остаются в почве после копки картофеля.
Самка после этого фактически тоже гибнет, она превращается в кокон–цисту, в которой до тысячи особей разного пола находятся в виде яиц, они, естественно, остаются в почве после копки картофеля.
Следующей весной, когда картофель будет высажен на это место, цисты разрываются, личинки выходят наружу и все повторяется заново.
Понятно, что нематода сильнейшим образом угнетает развитие картофельных растений, урожай падает в разы, а если почвы бедны, то нематода просто не дает поглощать питание корнями растений, а в лунках можно обнаружить не более пары мелких клубней.
Внешне можно видеть, что растения сильно отстают в росте от собратьев, при теплой погоде они словно скручиваются, потому что нематода не дает поглощать влагу из почвы, а если выдернуть растение из почвы, то также можно обнаружить несвойственное картофелю огромное количество тонких корней.
В общем и целом, описывать разного рода нематоду на различных растениях можно долго, лучше давайте перейдем к рассказу о мерах борьбы с этой заразой.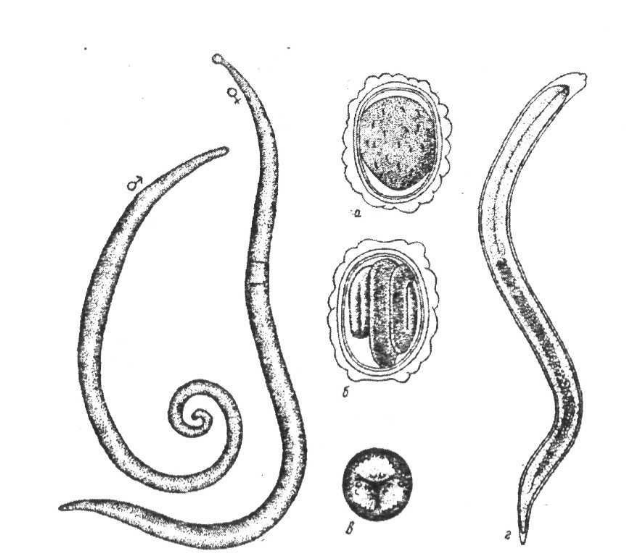
Меры борьбы с нематодой на участке
Если нематода каким-то образом попала к вам на участок, то остается только слушать профессионалов, хотя многие советуют просто подождать два-три года, продержав растения под черным паром, перекапывая участок под зиму с комом земли, не разбивая комьев, и тогда вы, может быть, истребите нематоду.
Но если вы хотите как можно скорее от нее избавиться, то для начала попробуйте использовать севооборот. То есть на участке, где заметили свекловичную нематоду, не высаживайте больше свеклу, а если заметили картофельную, то — картофель. Быть может, таким образом, удастся избавиться от определенного вида нематоды на своем участке.
После севооборота, который вряд ли поможет, действует более тяжелая техника, это фумигация, которая на текущий момент является максимально эффективным средством борьбы с вредителем, но она же и является вредным тоже.
Что такое фумигация?
Это обработка почвы, определенно зараженной нематодой (для чего заранее берутся пробы и анализы) разными сильно действующими ядами и даже их парами, причем иногда в раскаленном виде.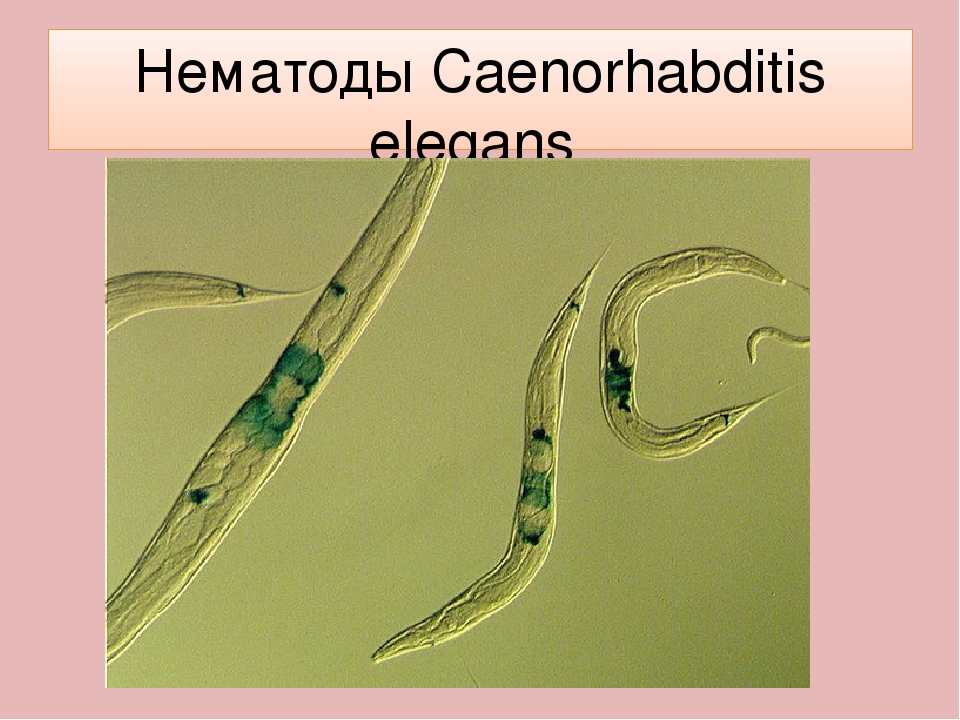
Этими препаратами можно как обрабатывать зараженные нематодами растения, так и проливать ими почву. Препараты эти довольно опасные и мы не советовали бы просто так лить химию, а лучше доверить это дело профессионалам, которые могут надежно обработать участок и уничтожить не только взрослых червей нематоды, которые погибают почти сразу, но и куда более живучих личинок, которым требуется порой несколько обработок.
На следующий год на данном участке лучше провести только контрольную высадку растений, заняв, скажем, треть участка самыми разными культурами и проверить, осталась ли нематода в почве.
Делаем выводы о нематоде
Нематода — опасный вредитель, нужно быть внимательным при покупке семенного материала, растений в закрытом грунте, да и просто рассады с частями грунта. Особенно обидно может быть владельцам небольших участков, которым придется ждать годы, чтобы хоть что-то можно было на них посадить, либо вносить литры химии для борьбы с вредной заразой без гарантии, что где-то все же не осталась циста с парой тысяч яиц.
Помните, что нематода — это и внешний, и внутренний карантинный объект. Вы не можете торговать продукцией зараженной нематодой, вы не можете пересаживать растения на другие участки с участков, зараженных нематодой. Если картофель выращен на участке, зараженном нематодой, то его можно пускать только в переработку и всего лучше — на корм сельскохозяйственным животным.
Если вы когда-нибудь имели дело с нематодой, опишите свой опыт в комментариях к статье, возможно, кому-то из читателей он очень пригодится.
НЕМАТОДЫ • Большая российская энциклопедия
В книжной версии
Том 22. Москва, 2013, стр. 353
Скопировать библиографическую ссылку:
Авторы: А. В. Чесунов
В. Чесунов
НЕМАТО́ДЫ, круглые черви (Nematoda), тип первичнополостных червей. Более 20 тыс. свободноживущих и паразитич. видов. По числу особей – самые многочисленные из многоклеточных животных планеты. Тело от веретеновидной до нитевидной формы, на поперечном срезе круглое (отсюда второе назв.). Длина 0,05–10 (реже 50) мм; некоторые паразитич. формы достигают в длину 20–40 см и даже более 8 м (Placentonema gigantissima из плаценты кашалота). Кутикула целиком покрывает тело, имеет сложное послойное строение, обладает избирательной проницаемостью для разл. веществ, осуществляет механич. защиту тела и является частью опорно-двигательной системы. Под кутикулой эпидермис образует продольные утолщения, т. н. хорды; самые широкие из них (боковые) разделяют спинную и брюшную ленты продольной косо исчерченной мускулатуры (кольцевые мышцы отсутствуют). При передвижении попеременно сокращаются спинные и брюшные мышцы, тело изгибается в спинно-брюшной плоскости (змеевидно). Рот находится на переднем конце тела. Мышечная насосная глотка имеет внутр. кутикулярный треугольный просвет. В средней кишке мышечный слой отсутствует, она отделена от соседних отделов кишечника клапанами; задняя кишка покрыта кутикулой. Продольные нервные стволы расположены в толще эпидермиса и связаны окологлоточным нервным кольцом. Органы чувств (сенсиллы с неподвижными рецепторными ресничками) преим. в виде хемо- и механорецепторов, расположенных в три круга на переднем конце тела и вдоль боков. Выделительную функцию выполняют одноклеточные эпидермальные железы и их производные, а также крупные клетки целомоциты, накапливающие и консервирующие продукты метаболизма, и клетки кишечника. Раздельнополые, оплодотворение внутреннее.
При передвижении попеременно сокращаются спинные и брюшные мышцы, тело изгибается в спинно-брюшной плоскости (змеевидно). Рот находится на переднем конце тела. Мышечная насосная глотка имеет внутр. кутикулярный треугольный просвет. В средней кишке мышечный слой отсутствует, она отделена от соседних отделов кишечника клапанами; задняя кишка покрыта кутикулой. Продольные нервные стволы расположены в толще эпидермиса и связаны окологлоточным нервным кольцом. Органы чувств (сенсиллы с неподвижными рецепторными ресничками) преим. в виде хемо- и механорецепторов, расположенных в три круга на переднем конце тела и вдоль боков. Выделительную функцию выполняют одноклеточные эпидермальные железы и их производные, а также крупные клетки целомоциты, накапливающие и консервирующие продукты метаболизма, и клетки кишечника. Раздельнополые, оплодотворение внутреннее. Половая система самцов представлена одним или двумя семенниками, семяпроводом (открывается в клоаку), двумя копулятивными кутикулярными спикулами, придаточными железами и др. У самок различают яичник, семяприёмник и матку. Гл. обр. яйцекладущие, редко живородящие виды. Развитие прямое, жизненный цикл обычно состоит из четырёх ювенильных (личиночных) и взрослой стадий.
Половая система самцов представлена одним или двумя семенниками, семяпроводом (открывается в клоаку), двумя копулятивными кутикулярными спикулами, придаточными железами и др. У самок различают яичник, семяприёмник и матку. Гл. обр. яйцекладущие, редко живородящие виды. Развитие прямое, жизненный цикл обычно состоит из четырёх ювенильных (личиночных) и взрослой стадий.
Свободноживущие Н. обитают в грунте водоёмов любой солёности и во всём диапазоне глубин, в обрастаниях подводных твёрдых поверхностей, в почве. Они играют важную роль в экосистемах почвы и грунта водоёмов, где их численность может достигать нескольких млн. особей на 1 м2. Паразиты животных и человека (зоонематоды) и растений (фитонематоды), вызывают нематодозы. Фитонематоды проникают во внутр. ткани стеблей, листьев и семяпочек или высасывают содержимое клеток корней. Зоонематоды встречаются у животных почти всех типов и практически во всех органах. У человека обнаружено ок. 30 видов Н., в т. ч. аскариды, кривоголовки, острицы, трихинеллы, филярии, власоглав человеческий, ришта.
Зоонематоды встречаются у животных почти всех типов и практически во всех органах. У человека обнаружено ок. 30 видов Н., в т. ч. аскариды, кривоголовки, острицы, трихинеллы, филярии, власоглав человеческий, ришта.
Нематоды разнокожие | справочник Пестициды.ru
Гетеродериды обладают высоким уровнем адаптации к корневому паразитизму, обеспечивающему гарантированные условия питания и защиты потомства от хищников и патогенных микроорганизмов в пределах цисты. Виды семейства способны сохранять жизнеспособность от года до десяти лет при отсутствии кормового растения.[3]
История
Цистообразующие нематоды впервые были найдены ботаником Шахтом на Магдебургской равнине на корнях сахарной свеклы. Позднее Шмидт назвал эту нематоду Heterodera schachtiiв честь ученого, нашедшего ее.
В последующие десятилетия цистообразующие нематоды были зарегистрированы на многих других сельскохозяйственных растениях: овсе, ячмене, горохе, клевере, картофеле и прочих.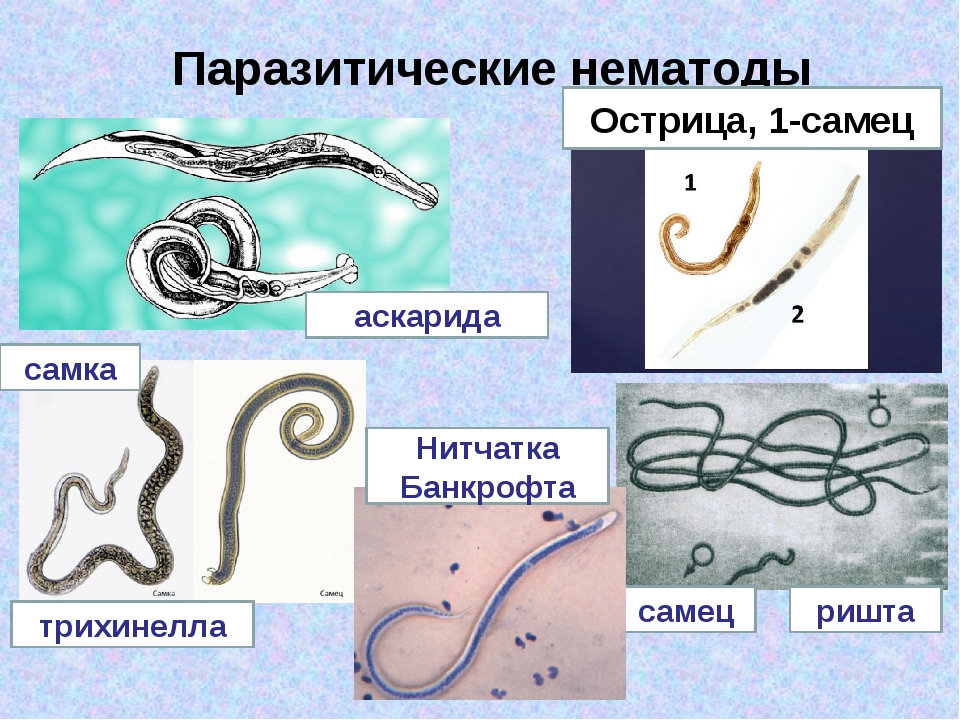 Долгое время все находки относили к одному виду – Heterodera schachtii.
Долгое время все находки относили к одному виду – Heterodera schachtii.
В дальнейшем были выделены различные расы свекловичной нематоды, а затем и отдельные виды.[2]
Морфология
Имаго
Половозрелые особивсех представителей семейства Heterodera отличаются ярко выраженным половым диморфизмом.[2]
Половой диморфизм
Самки в течение развития принимают шаровидную, лимоновидную или грушевидную форму. Они способны образовывать многочисленные яйца, преимущественно остающиеся в теле и защищенные оболочкой (цистой).[2] Взрослые самкибелого цвета, неподвижные. Чаще всего на поверхности корня выступает часть или все тело самки. Передний конец тела всегда погружен в корень в месте питания.[3]
Циста. Размер колеблется от 0,2 до 1, 1 мм. Окрас в зависимости от вида и возраста светло-, темно- или красно-коричневый. Оболочка состоит из трех слоев.[2]
Самец. Тело стройное, длиной 1–1,5 мм. Хвост тупой, закругленный. Спикулы расположены вблизи кончика хвоста. Бурса отсутствует. У некоторых видов самцов нет и размножение происходит партеногенетическим путем.[2]
Тело стройное, длиной 1–1,5 мм. Хвост тупой, закругленный. Спикулы расположены вблизи кончика хвоста. Бурса отсутствует. У некоторых видов самцов нет и размножение происходит партеногенетическим путем.[2]
Яйцо
Форма продолговато-овальное. Размер варьирует от 89 х 42 мкм у хмелевой нематоды до 122 х 48 мкм у злаковой нематоды. Яйца в начале развития заполнены зернистым содержимым, позднее оно дифференцируется постепенным дроблением до образования личинки.[2]
Личинки инвазионные второго возраста
Длина – 0,4–0, 6 мм. Тело червеобразное. Обладают сильным ротовым стилетом и заостренным хвостом. Самые крупные – у овсяной и злаковой нематоды, самые мелкие – у капустной и хмелевой нематоды.[2]
Развитие
Имаго. Развитие самцов и самок нематод в половозрелом возрасте различное.[3]
Самка в начале развития имеет белую окраску. После откладки яиц самки отмирают и превращаются в цисту – выводковую камеру. Стенки цисты становятся прочными и темными. У некоторых видов проявляется коричневая окраска. Цисты покрыты субкристаллиновым слоем, состоящим из остатков личиночных оболочек. Позднее этот слой разрушается. Поэтому у некоторых видов они остаются белыми до момента его опадения.[2]
Стенки цисты становятся прочными и темными. У некоторых видов проявляется коричневая окраска. Цисты покрыты субкристаллиновым слоем, состоящим из остатков личиночных оболочек. Позднее этот слой разрушается. Поэтому у некоторых видов они остаются белыми до момента его опадения.[2]
Самец живет не дольше 10 дней. Не питается. После оплодотворения отмирает.[3]
Период спаривания. Самцы оплодотворяют самок сразу после наступления половой зрелости последних, поскольку самки выделяют привлекающее вещество. У некоторых видов самцов нет и размножение проходит партеногенетическим путем. В течение месяца после оплодотворения самки откладывают яйца. Их количество колеблется от нескольких штук до нескольких сотен. Некоторые виды образуют желатиновый мешок, расположенный на вульварном конце цисты. В него также откладывается часть яиц.[2]
Яйцо. Длительность эмбрионального развития зависит от условий окружающей среды и вида нематоды. [2]
[2]
Личинка. Развитие личинок протекает в несколько стадий.
Первая стадия протекает внутри яйцевой оболочки и завершает эмбриональное развитие. Поэтому цисты уже на ранних стадиях развития содержат многочисленные личинки первой стадии.
Вторая стадия. Личинки способны к передвижению и нападению на растения. Они выходят из цисты и свободно передвигаются в почве.
Личинки проникают в растение в основном сразу позади кончика корня. После этого их тело слегка утолщается. Вторая стадия завершается линькой через 1–2 недели после проникновения в растение.
Третья стадия. Личинка утолщается до бутылковидной формы. Половые органы заметны. Ректум виден ясно.
Четвертая стадия. Личинка, развивающаяся в самку, утолщается. Из-за этого корень разрывается и задний конец самки выступает наружу. Самки развиваются дольше самцов.
Будущие самцы приобретают червеобразную форму, перестают питаться. Развивающиеся самцы лежат в личиночной шкурке, сложенные многократно. Длится стадия 4–5 дней. Самцы выползают из шкурок и покидают корни.[2]
Развивающиеся самцы лежат в личиночной шкурке, сложенные многократно. Длится стадия 4–5 дней. Самцы выползают из шкурок и покидают корни.[2]
Имаго. Самцы оплодотворяют самок и отмирают. Самки откладывают яйца в полость своего тела и превращаются в цисты.[3]
Особенности развития. Длительность развития одного поколения и количество генераций зависит от вида нематоды, растения-хозяина и условий окружающей среды.[3]
Географическое распространение
Семейство гетеродерид имеет широкое распространение. Представители этого семейства встречаются практически по всему миру.[2]
Меры борьбы
Агротехнические методы
В открытом грунте
- Введение в севооборот культур, не поражаемых нематодами.
- Борьба с сорняками – хозяевами нематод семейства гетеродерид.[2]
Механические методы
Применяются в теплицах.
- Обеззараживание почвы путем выпаривания или вымораживания.
- Предотвращение занесения нематод в незараженный грунт.
- Полив чистой водопроводной водой.
- Уничтожение пораженных частей растений.[2]
Химические методы
Протравливание почвы нематицидами.[1]
Нематода
Описание
Нематода. Характерные черты вредителя
Нематоды – это круглые черви принадлежащих к типу первичнополостных червей. Основной вред наносят различным овощным культурам. Встречаются различные виды нематод. Среди вредителей огорода наиболее можно выделить земляничную, свекловичную, картофельную и корневую нематоду. Земляничная нематода является опасным вредителем для данных ягод. В длину достигает не более 1 миллиметра, что делает его практически невидимым. Вредит стеблю, листьям и ягодам. При заражении нематодой земляника формируют уродливые листочки, плоды не образуются, растение во многом отстает в развитии от своих здоровых собратьев. Свекловичная нематода поражает свеклу, она пробуривает листья, в 2-3 раза уменьшает размер плода, а также снижает содержание сахара в овоще. Картофельная нематода – червяк размером в 1 миллиметр, встречается на корнях картофеля и томата. Развивается в клубне картофеля. Одна самка может сформировать до тысячи яиц. Картофельная нематода снижает урожай, угнетает растение, препятствует формированию клубней. Корневые нематоды – нитчатые черви, которые вызывают галлы на корнях. Самцы имеют вытянутую форму, достигают двух миллиметров, самки более широкие, чем самцы. Данный вид нематод наносит вред большинству видов растений, кустарникам, деревьям, овощным и декоративным культурам. Развитие одной особи происходит за 20-50 дней. Одна самка за свою жизнь может отложить до 2000 яиц. Как и остальные виды нематод, картофельные снижают урожайность, ухудшают рост растения, способствуют развитию различных болезней.
Борьба с нематодой
Борются с нематодами при помощи системных и контактных ядов. Также хорошо себя зарекомендовала термическая обработка корней. Растение выкапывается, а корни купают при температуре пятидесяти градусов. При покупке рассады необходимо удостовериться в отсутствии данного вредителя. Зараженные растения, по возможности, уничтожают.
Паразитические круглые черви
Виноградов Д.Д., Хромова М.Р.
Общая характеристика круглых червей
Нематоды, или собственно круглые черви (Nematoda), – тип первичноротых первичнополостных билатерально симметричных линяющих животных.
Распространение. Нематоды – один из самых широко распространенных типов животных, которые смогли освоить самые разные среды обитания – начиная от интерстициали (пространства между песчинками) и моховых сообществ и заканчивая арктическими льдами (как, например, Theristis melnikovi и Cryonema crissum, найденные в толще многолетнего льда в центральной части Северного Ледовитого океана). Особый интерес для исследователей представляют паразитические нематоды, в том числе ввиду большого разнообразия их хозяев.
План строения. Тонкое веретеновидное тело, сужающееся к концам, круглое в поперечном сечении. На переднем конце располагается рот, а на заднем порошица (анус). Снаружи тело покрыто многослойной эластичной кутикулой – неклеточным образованием, выделяемым гиподермой. Гиподерма, или эпидермис, располагается под кутикулой. Мускулатура представлена слоем продольных косо исчерченных мышечных волокон. Первичная полость тела (схизоцель), лишенная собственной эпителиальной выстилки, заполнена жидкостью.
Пищеварительная система. Ротовое отверстие на переднем конце тела окружено выступами – губами (обычно тремя) и ведет в мускулистую эктодермальная глотку с трехгранным просветом. Глотка ведет в энтодермальную среднюю кишку из одного слоя цилиндрических эпителиальных клеток. Далее идет короткая эктодермальная задняя кишка, открывающаяся анальным отверстием.
Выделительная система. Органы выделения — одноклеточные железы, заменившие протонефридии. Обычно имеется одна шейная железа в передней части тела, от нее отходит короткий выделительный проток. Также имеются «почки накопления» – фагоцитарные органы, накапливающие нерастворимые продукты обмена веществ, которые не удаляются из тела.
Кровеносная и дыхательная системы. Эти системы отсутствуют. Дыхание происходит через кожу. Возможен также анаэробный метаболизм (анаэробное расщепление гликогена до масляной и валериановой кислот у паразитов).
Нервная система. Нервная система стволовая лестничного типа. Представлена нервным кольцом и шестью продольными стволами. Два нервных ствола, проходящие по брюшной и спинной линии, более мощные, соединены полукольцевыми нервными перемычками (комиссурами).
Органы чувств. Имеются папиллы и щетинки – органы осязания, расположенные вокруг рта. У некоторых морских представителей обнаружены примитивные глаза – пигментные пятна. Органы химического чувства, амфиды, обычно имеют форму кармана, спирали или щели. Они располагаются по бокам головного конца и особенно хорошо развиты у самцов, так как помогают в поиске самок.
Размножение и развитие. Нематоды – раздельнополые животные. Внутренние половые органы парные, имеют трубчатое строение. Размножение только половое. Половой диморфизм выражен: самки крупнее, у самцов задний конец тела загнут. Оплодотворение внутреннее, встречается живорождение. Нематоды в развитии проходят четыре личиночные стадии, разделенные линьками, которые сопровождаются сбрасыванием кутикулы. Третья стадия у некоторых видов (в том числе у знаменитой Caenorhabditis elegans) при неблагоприятных условиях видоизменяется в так называемую дауер-стадию – покоящуюся личинку.
Паразитизм. В настоящее время из более чем 24000 описанных видов нематод около половины относятся к паразитическим. Они могут поражать почти все ткани и органы: соединительные ткани, мышцы, кровеносные и лимфатические сосуды, гонады, органы чувств, а также полость тела и т. д. Среди них встречаются как экто-, так и эндопаразиты растений, позвоночных и беспозвоночных животных, в том числе других нематод, и даже простейших.
Далее следуют описания наиболее значимых с точки зрения медицинской паразитологии представителей круглых червей.
Человеческая аскарида (Ascaris lumbricoides)
Внешний вид. Заостренное на концах тело розовато-белого цвета. Размеры: самцы – 15-25 см, самки – 20-40 см (рис. 1). Тело покрыто десятислойной гибкой кутикулой, защищающей от механического воздействия и пищеварительных ферментов хозяина.
Рис. 1. Человеческая аскарида: самка, самец, яйцо
Распространение. Вид космополитичен – распространен повсеместно, но в разных странах разный процент зараженных. В Японии, например, более 90% населения заражено аскаридой из-за использования человеческих экскрементов в качестве удобрений. В зонах с жарким сухим климатом аскарида встречается реже.
Жизненный цикл. Развитие протекает без смены хозяев (рис. 2). Взрослые черви паразитируют в тонком кишечнике, вызывая аскаридоз. Человека обычно поражают несколько десятков аскарид (рекорд – 900 штук). Срок жизни в кишечнике – около одного года. Аскариды раздельнополы, как и другие нематоды. Половозрелая самка откладывает в сутки около 200 тысяч яиц овальной формы, которые с испражнениями попадают во внешнюю среду. Аскариды относятся к геогельминтам – для них обязательно развитие личиночной стадии в почве. При попадании в благоприятные условия (во влажную почву при температуре около 25 °C и при достаточном доступе кислорода) в яйце развивается личинка. Срок развития варьируется от 16 дней до нескольких месяцев и зависит от температуры воздуха. Такие яйца, содержащие личинку, можно считать инвазионными.
Рис. 2. Жизненный цикл человеческой аскариды
Заражение происходит при проглатывании яиц с пищей или водой, передача напрямую от человека к человеку не осуществляется. В кишечнике личинки пробуравливают стенку кишки, попадают в кровеносные сосуды и печень и далее совершают миграцию через нижнюю полую вену в правое предсердие и правый желудочек. Из последнего по малому кругу кровообращения личинки движутся в легкие, где из крови переходят в легочные пузырьки, бронхи, дыхательное горло и ротовую полость. В ротовой полости происходит вторичное заражение: личинки проглатываются, попадают в кишечник и через три месяца становятся половозрелыми. Процесс «взросления» у нематод связан с линьками (обычно их четыре).
Клиническая картина аскаридоза. На миграционной стадии аскаридоза наблюдается кашель (помогает личинкам попасть в глотку), боль в груди, аллергические реакции, повышенная температура.
На кишечной стадии происходит повреждение слизистой оболочки кишечника и отравление организма ядовитыми продуктами обмена веществ. Симптомы: тошнота, рвота, нарушения стула, снижение аппетита.
Долговременные эффекты заражения: общее снижение работоспособности, нарушения сна. При заползании червей в желчные протоки и дыхательные пути – летальный исход. Также личинки аскариды могут попадать в головной мозг (например, из нижней полой вены в верхнюю, далее по плечеголовной), вызывая менингоэнцефалит, сопровождающийся мигренями.
Профилактика. Мытье рук перед едой и приготовлением пищи. Мытье овощей и фруктов. Яйца также разносятся мухами, так что борьба с этими двукрылыми посредством, например, липучек тоже способствует профилактике аскаридоза.
Интересный факт. Есть исследования, показывающие положительное влияние заражения аскаридами на облегчение симптомов аутоиммунных заболеваний и повышения плодовитости у женщин. Ученые связывают это с воздействием паразитов на иммунную систему посредством влияния на уровень T-клеток в организме, но на данный момент механизм слишком малоизучен, чтобы делать достоверные выводы.
Острица (Enterobius vermicularis)
Внешний вид. Серовато-белая нематода, самцы длиной 2-5 мм, самки – 8-14 мм. Хвостовой конец заостренный (отсюда и название). На переднем конце тела заметно характерное вздутие пищевода (рис. 3).
Рис. 3. Острица
Жизненный цикл. Острицы паразитируют в нижней части тонкого кишечника и толстом кишечнике (рис. 4), вызывая энтеробиоз. Срок жизни – 1-2 месяца. Передним концом острицы прикрепляются к стенке кишки. Половозрелая самка из толстого кишечника выползает через задний проход и откладывает на кожу возле анального отверстия от 5 до 15 тысяч яиц, после чего погибает.
Выползание самок сопровождается зудом. При расчесывании кожи яйца переносятся на руки и не только. Также в переносе яиц участвуют мухи. Заражение происходит при заглатывании. Из попавших в кишечник яиц выводятся личинки.Рис. 4. Жизненный цикл острицы
Эпидемиология и клиническая картина энтеробиоза. Энтеробиоз распространен повсеместно, особенно часто встречается у детей из-за несоблюдения правил личной гигиены, «скученности» в детских садах и школах. Передается от человека к человеку без промежуточного хозяина. Снижает эффект вакцинаций.
Симптомы: боли в животе, снижение аппетита, головные боли, аллергические проявления, перианальный зуд (приводит к нарушениям сна, повышает раздражительность).
Трихинелла (Trichinella spiralis)
Описание. Мелкая нематода длиной 2-4 мм (рис. 5). Паразитирует в слизистой оболочке тонкого кишечника. Распространена в Евразии и Северной Америке.
Рис. 5. Трихинелла
Жизненный цикл. Для развития трихинеллы необходима смена хозяев. Обычно это дикие животные (лисы, волки, медведи, кабаны), а также люди и скот. Самки закрепляются передним концом тела в кишечный эпителий и рождают 1-2 тысячи личинок. Свойственно яйцеживорождение: вылупление личинок из яиц происходит в половых путях самки. Личинки по кровеносным и лимфатическим сосудам разносятся по всему телу и оседают в поперечно-полосатых мышцах. На этой стадии у них есть стилет, они разрушают с его помощью мышечную ткань, вызывая формирование хозяином капсулы, в которой, свернувшись спиралью, пребывают в дальнейшем. Через несколько месяцев капсула пропитывается известью. Такая мышечная трихина может существовать несколько лет и выжить даже после гибели хозяина и разложения его трупа.
Попав в желудок нового хозяина (после поедания им трупа предыдущего) личинки освобождаются от капсулы (рис. 6.), проникают в слизистую оболочку и в течение пары дней, претерпев четыре линьки, превращаются во взрослых червей.
Рис. 6. Развитие трихинеллы в организме человека
Клиническая картина трихинеллеза. Повышение температуры, одутловатость лица, боли в мышцах, аллергические реакции.
Профилактика. Трихинеллез передается пищевым путем, через зараженное мясо. Поэтому для профилактики заболевания мясо должно пройти ветеринарную экспертизу и быть правильно приготовлено – проварено в течение 2-3 часов. Такие методы приготовления, как копчение и соление, трихинелл не уничтожают.
Власоглав (Trichocephalus trichurus)
Внешний вид. Червь беловатого цвета, длиной около 4 см (рис. 7). Передний конец утончен, напоминает волос (отсюда и название).
Рис. 7. Власоглав
Распространение. Предпочитают страны с влажным и теплым климатом.
Жизненный цикл. Жизненный цикл власоглава показан на рис. 8. Червь паразитирует в начальном отделе толстой кишки, только на человеке. Вызывает трихоцефалез. Длительность жизни в человеке – несколько лет. Тонким концом проникает в толщу слизистой оболочки стенки кишки. Питается тканевой жидкостью и кровью.
Самка откладывает 1-3 тысячи яиц, которые с фекалиями попадают во внешнюю среду. Как и аскарида, власоглав относится с геогельминтам: для того чтобы яйца стали инвазивными, им необходимо пребывание в почве при определенной влажности и температуре (25-30 °C) в течение месяца. После этого происходит заражение при проглатывании яиц, в кишечнике хозяина из них выходят личинки, проникают в кишечные ворсинки и растут в них около недели. Затем, разрушив ворсинки, они выходят в просвет кишечника, достигают толстой кишки, закрепляются там и за месяц достигают половозрелости.
Рис. 8. Жизненный цикл власоглава
Клиническая картина трихоцефалеза. Червь повреждает слизистую оболочку толстой кишки и вызывает отравление хозяина продуктами жизнедеятельности. Власоглав – гематофаг, поэтому может привести к малокровию. Трихоцефалез сопровождается болями в животе, головными болями и головокружениями. Из-за того что власоглав прикрепляется к стенке кишечника, его извлечение из организма хозяина труднее, чем извлечение других паразитов.
Внешний вид. Тонкая беловатая нематода (рис. 9), самки 30-120 см в длину, самцы не более 4 см. На хвосте имеется маленький шип.
Рис. 9. Ришта: слева – взрослая самка, справа – личинка в циклопе (по Павловскому)
Распространение: тропические страны Азии и Африки.
Жизненный цикл. Заражение происходит при употреблении некипячёной воды с веслоногими рачками (рис. 10). Рачки в желудке под действием соляной кислоты погибают, а вот личинки ришты выживают и через лимфатическую систему разносятся по организму. Далее они проникают в полость тела, там линяют и достигают половой зрелости. После спаривания самец погибает, а самка перемещается в подкожную клетчатку, где образуется гнойный нарыв, сопровождающийся жжением и болью. Для облегчения боли лучше всего подходит прохладная вода.
Развитие яиц заставляет самку начать «головой» вперед продвигаться к кожной поверхности, оставляя на своем пути воспалительный процесс, переходящий в гнойный нарыв, который после лопается. Матка самки при попадании в воду разрывается, и личинки, вылупившиеся из яиц, выходят наружу. Чтобы развитие не прерывалось, личинки должны заразить рачка-циклопа, являющегося промежуточным хозяином. Те личинки, которые останутся в воде, погибают. После проглатывания рачков окончательным хозяином под воздействием желудочной кислоты рачки растворяются, а личинки без труда попадают в кишечник, пробираются сквозь его стенки и оказываются в лимфатических узлах, где продолжается цикл развития. Заболевание, вызываемое риштой, носит название дракункулёз.
Рис. 10. Жизненный цикл ришты
Дракункулёз. Инкубационный период продолжается до девяти месяцев и завершается к моменту достижения самкой половой зрелости. А у человека, уже заболевшего дракункулёзом, в это время начинают образовываться гнойные нарывы. Единственное спасение от боли — водоем. Облегчение моментальное, но во время контакта с водой пузыри разрываются, и ришта выбрасывает личинок в воду. Рачки их поглощают, и жизненный цикл начинается снова.
При лечении дракункулёза нередко делают надрез на месте волдыря и понемногу вытягивают червя, наматывая его на палочку. Это занимает дни, а иногда и недели (вытягивать червя приходится медленно и аккуратно, чтобы он не порвался). Высказывались предположения, что вид ришты, намотанной на палочку, стал своеобразным прототипом символа медицины – посоха Асклепия, обвитого змеей (рис. 11).
Рис. 11. Ришта, извлекаемая из ноги человека, страдающего дракункулёзом
Нитчатка (филиярия) Банкрофта, или Банкрофтов струнец (Wuchereria bancrofti)
Внешний вид. Белая нитевидная нематода, самки длиной 10 см, самцы – 4 см (рис. 12).
Рис. 12. Филярия Банкрофта
Распространение. Тропики, субтропики Азии, Африки, Центральной и Южной Америки.
Жизненный цикл. Взрослые особи обычно встречаются в лимфатических железах и сосудах, затрудняя отток лимфы и вызывая постоянный отек. Самки производят личинок – ночных микрофиллярий, которые по ночам появляются в периферической крови, а днем уходят в глубь тела (в легочные сосуды и почки). Это связано с тем, что промежуточным хозяином являются комары, которые сосут кровь обычно в вечерне-ночное время. Личинки попадают в желудок комара, затем в полость тела, где подрастают, после чего скапливаются возле хоботка, из которого передаются человеку при сосании крови. Нитчатки Банкрофта вызывают элефентиаз, или элефантиазис, или слоновую болезнь. Стоит отметить, что это заболевание также могут вызывать другие нематоды.
Клиническая картина и лечение элефантиаза. Происходит увеличение какой-либо части тела (рис. 13) за счет гиперплазии (болезненного разрастания) кожи и подкожной клетчатки, которая вызвана воспалительным утолщением стенок лимфатических сосудов и застоем лимфы, происходящим из-за закупоривания лимфатических сосудов взрослыми особями нитчатки Банкрофта. Кожа на больной части тела покрывается язвами.
Лечение элефантиаза направлено на улучшение оттока жидкости. Эффективно применение противогельминтных препаратов, таких как авермектин. На поздних стадиях может потребоваться хирургическое вмешательство.
Рис. 13. Больной, страдающий элефантиазом (по Брунту)
Список литературы
Генис Д. Е. Медицинская паразитология. 5-е изд. 2017.
Догель В. А. Зоология беспозвоночных: Учебник под редакцией Ю. И. Полянского. 8-е изд. Москва, 2015.
Заяц Р. Г. ЕГЭ. Биология в таблицах, схемах и рисунках. 6-е изд. Ростов н/Д: Феникс, 2013.
Чесунов А. В. Биология морских нематод. М.: T-во научных изданий КМК, 2006.
НЕМАТОДЫ — это… Что такое НЕМАТОДЫ?
НЕМАТОДЫсобственно круглые черви (Nematoda), класс первичнополостных червей. Известны с верхнего карбона. Тело несегментированное, нитевидное, веретеновидное, реже (у самок) бочонковидное или лимоновидное, круглое в поперечнике (отсюда второе назв.). Свободноживущие Н. очень мелкие — от 0,05 до 5 (редко до 50) мм; паразитич. формы, обычно мелкие, но нек-рые достигают дл. 20—40 см и даже 8,4 м (Placentonema gigantissima из плаценты кашалота). Под кутикулой расположена гиподерма. Мускулатура продольная, однослойная. Органы чувств — губные папиллы (сосочки), осязат. щетинки, обонят. амфиды; у нек-рых видов — глазки (фоторецепторы). Мн. формы имеют сенсорно-железистые органы — фазмиды, а на заднем конце тела свободноживущих Н.— терминальные хвостовые железы (секрет их служит для прикрепления Н. к субстрату). По всему телу свободнолшвущих Н. расположены кожные железы. Орган выделения — одноклеточная шейная железа. Раздельнополые. Яйцекладущие, реже живородящие. Свободноживущие Н. питаются бактериями, водорослями, детритом; есть хищники, многие — паразиты животных, грибов и растений. 2 подкласса — аденофореи и сецерненты (по др. системе — 3 подкласса). Ок. 20 тыс. видов. Распространены всесветно, в морях, пресных водах и почве.
Схема строения нематод. Слева — самка, справа — самец: 1 — ротовая полость; 2 — пищевод; 3 — бульбусы пищевода; 4 — окологлоточное нервное кольцо: 5 — выделительная пора; 6 — средняя кишка: 7 — яичник; 8 — яйцевод: 9 — матка; 10 — яйцо в матке; 11 — женское половое отверстие; 12 — задняя кишка; 13 — анус; 14 — семенник;15 — семяпровод; 16 — семяизвергательный канал; 17 — спикулы; 18 — бурсальные крылья; 19 — рёбра бурсы (органы осязания).
.(Источник: «Биологический энциклопедический словарь.» Гл. ред. М. С. Гиляров; Редкол.: А. А. Бабаев, Г. Г. Винберг, Г. А. Заварзин и др. — 2-е изд., исправл. — М.: Сов. Энциклопедия, 1986.)
немато́дыкласс круглых червей. Известно св. 20 тыс. видов. Свободноживущие виды обитают в почве, морях, пресных водоёмах и питаются бактериями, водорослями, органическими частицами; ок. 50 видов – паразиты грибов, растений, животных и человека. Имеют удлинённые нечленистые цилиндрические тела, заострённые на обоих концах, покрытые кутикулой. Между кишкой и стенкой тела имеется первичная полость тела – псевдоцелома. Длина нематод – от нескольких миллиметров (филярии, трихинеллы) до нескольких метров (ришта). Раздельнополые. Самки несколько крупнее самцов. Поражая растения, вызывают гибель корней и порчу корнеплодов (свекловичные, картофельные, овсяные нематоды), образование галлов (галловые нематоды). Стеблевые нематоды вызывают растрескивание стеблей, гофрировку листьев (луковичные растения, земляника), порчу клубней заложенного на хранение картофеля. Нематоды, паразитирующие в организме свиней, лошадей, плотоядных, – возбудители инвазионных болезней. Для человека наиболее опасны аскариды, трихинеллы, филярии и ришта. Заражение ими происходит при несоблюдении правил личной гигиены.
.(Источник: «Биология. Современная иллюстрированная энциклопедия.» Гл. ред. А. П. Горкин; М.: Росмэн, 2006.)
.
границ | Идентификация видов нематод — текущее состояние, проблемы и перспективы развития циатостоминов
Введение
Паразитические гельминты влияют на здоровье людей и животных во всем мире и могут иметь зоонозное значение (например, Ascaris spp.). У лошадей наиболее важные кишечные нематоды принадлежат к семейству Strongylidae и состоят из двух подсемейств: Strongylinae, включающих 14 видов в 5 родов ( Strongylus, Oesophagodontus, Triodontophorus, Bidentostomum и Craterostomum ), и 50 допустимых видов в 14 родах ( Caballonema, Coronocyclus, Cyathostomum, Cylicocyclus, Cylicodontophorus, Cylicostephanus, Cylindropharynx, Gyalocephalus, Hsiungia, Parapoteriostomum, Petrovinema, Poteriostomum, Scrjibridentichlus., 2008), в отличие от предыдущих публикаций, перечисляющих 51 или 52 вида в 13 родах (Lichtenfels, 1975; Lichtenfels et al., 2002). В литературе термин «маленькие стронгилы» был введен для обозначения только Cyathostominae или всех конских стронгилид, за исключением рода Strongylus , которые были обозначены как «большие стронгилы» (Lyons et al., 1999). Несмотря на то, что он все еще широко используется, в настоящее время рекомендуется избегать терминов малый и большой стронгилы (Lichtenfels et al., 2002).
Поскольку распространенность высокопатогенного вида Strongylus снизилась после введения макроциклических лактонов (Herd, 1990), циатостомины в настоящее время признаны наиболее важными паразитами лошадей из-за (i) их распространенности до 100% среди лошадиных (Lyons и другие., 1999), (ii) многочисленные сообщения об устойчивости к глистогонам и (iii) их патогенность, которая особенно проявляется в случаях иногда летального личиночного циатостоминоза (Love et al., 1999). Устойчивость к глистогонам к бензимидазолам широко распространена во всем мире, также часто наблюдается устойчивость к пирантелу, тогда как о снижении эффективности макроциклических лактонов сообщалось редко (Kaplan, 2002; Kuzmina and Kharchenko, 2008; Von Samson-Himmelstjerna, 2012; Matthews, 2014; Nielsen et al. ., 2014).
Циатостомины имеют прямой жизненный цикл со взрослыми особями, расположенными в просвете слепой и толстой кишки, выделяя яйца с фекалиями. Первые личинки (L1) вылупляются с фекалиями, дважды линяют до инфекционных третьих личинок (L3), которые поедаются непарными. В толстом кишечнике L3 энцистирует внутри кишечной стенки и может также претерпевать гипобиоз в течение нескольких месяцев, прежде чем линька до четвертой личинки (L4) (Corning, 2009). Синхронная эксцистация большого количества личинок гипобиотов потенциально вызывает циатостоминоз личинок, характеризующийся тяжелым воспалением, приводящим к потере веса, диарее, коликам или даже смерти (Love et al., 1999).
Несмотря на то, что циатостомины представляют угрозу благополучию лошадей, и часто предпринимаются научные усилия для решения этой проблемы, исследования затрудняются из-за отсутствия достаточных методов идентификации (Lichtenfels, 2008). Эта перспектива касается различных методов, их преимуществ и ограничений и дает представление о возможных будущих методах идентификации нематод с использованием циатостоминов в качестве парадигмы.
Пробы и отбор проб
Первой проблемой при идентификации видов является наличие подходящих образцов.Хотя яйца стронгилидов можно легко собрать из фекалий, они практически не имеют диагностически полезных морфологических особенностей. Стронгилид L3 можно получить из яиц с использованием различных методов культивирования фекалий (Smyth, 1990). Однако только некоторые L3 могут быть идентифицированы до уровня рода, и это требует высокого уровня опыта. Только для нескольких видов in vitro была описана культура в L4 (Chapman et al., 1994; Brianti et al., 2009). Следовательно, взрослых паразитов необходимо собирать у естественно инфицированных хозяев.У лошадей лишь несколько взрослых стронгилов иногда выделяются с фекалиями, но сбор взрослых нематод из фекалий после антигельминтной обработки возможен (Osterman Lind et al., 2003; Кузьмина и др., 2005; Кузьмина, Харченко, 2008). Тем не менее, полная нагрузка червей, представляющая все виды живой лошади, может быть задокументирована только путем исследования всех фекалий в течение нескольких дней, что может быть связано с деградацией червей, что приведет к искаженным результатам. Более точным и значимым методом является сбор взрослых нематод из содержимого кишечника лошади (Drudge, Lyons, 1977).Критический метод испытаний, который подробно описан Drudge et al. (1963), представляет собой комбинацию как сбора кала в течение недели, так и сбора во время вскрытия трупа. Этот метод широко используется для изучения эффективности глистогонных соединений (например, Lyons et al., 2007, 2010). Из-за необходимости приносить в жертву или забивать лошадей эти методы ограничены исследованиями. Таким образом, существует большая потребность в разработке альтернатив для точной диагностики нематод у живых лошадей. Поэтому ближайшей целью исследования является разработка эффективных и специфических неинвазивных методов идентификации циатостомина.
Морфологическая идентификация
За более чем 100 лет (Molin, 1861; Loos, 1900) большое количество видов циатостомина было морфологически описано с использованием 93 различных названий. Между тем, несколько ранее описанных видов считаются синонимами (Lichtenfels et al., 1998), а в настоящее время 50 видов признаны действительными. Были опубликованы исчерпывающие идентификационные ключи, обобщающие описания (Lichtenfels, 1975; Tolliver, 2000; Lichtenfels et al., 2008).
Морфологическая идентификация взрослых стронгилей основывается на тщательном исследовании слабых признаков на переднем конце взрослых нематод или репродуктивной системы. Эти черты включают размер и форму буккальных капсул, внутренних и внешних коронок листа и его дополнительную хитиновую опору, как показано на рисунке 1, чтобы указать на очень слабые различия. Тонкие морфологические структуры заднего конца, такие как размер и форма бурсы, генитального конуса, губернакула и спикул у самцов, а также форма хвоста, размер и соотношение различных частей репродуктивной системы у самок также имеют важное значение для дифференциации видов (Lichtenfels , 1975; Двойнос, Харченко, 1994; Lichtenfels et al., 2008). Однако надежная морфологическая идентификация взрослых циатостоминов может быть достигнута только после нескольких лет интенсивного обучения, и в настоящее время во всем мире доступно лишь несколько экспертов (Lichtenfels et al., 2008).
Рисунок 1 . Сравнение методов морфологической и протеомной идентификации видов. Показаны передние концы и типичные MALDI-TOF MS-спектры трех видов циатостомина из близкородственных видов (A) Coronocyclus coronatus , (B) Coronocyclus labiatus и (C) Coronocyclus labratus . .Масштабные линейки представляют 100 мкм. Оси x показывают отношения массовых зарядов, а оси y представляют собой произвольные единицы интенсивности. Спектры вычитали и сглаживали с использованием параметров по умолчанию в программном обеспечении flexAnalysis (Bruker Daltonics). Образцы очищали лактофенолом для улучшения видимости структурных особенностей кутикулы. Наружная и внутренняя листовая крона обозначены черными и белыми стрелками соответственно.
Принимая во внимание, что взрослые циатостомины можно различить, яйца L1 и L2 нельзя отличить от других нематод семейства Strongylidae.Идентификация L3 возможна для некоторых родов, таких как Strongylus, Triodontophorus, Gyalocephalus или Poteriostomum , в то время как большинство других можно отнести только к нескольким типам личинок циатостомина (Bevilaqua et al., 1993; Santos et al., 2016). Морфологические особенности включают качественные и количественные признаки, такие как количество, расположение и форма клеток кишечника / средней кишки, длина кишечника и длина оболочки хвоста.
Молекулярные методы
Чтобы преодолеть ограничения морфологической идентификации, исследования были сосредоточены на молекулярной идентификации циатостомина.Эти методы, после правильной реализации целевых последовательностей, могут применяться независимо от стадии жизни нематод.
Целевым локусом, который оказался полезным для разработки генетических маркеров для диагностических и филогенетических целей, является рибосомная ДНК (рДНК) (обзор Gasser and Newton, 2000; Chilton, 2004). Ядерная рДНК эукариот организована в кластеры, иногда из нескольких сотен повторов. Кодирующие последовательности для 18S, 5.8S и 28S рРНК прерываются первым и вторым внутренне транскрибируемыми спейсерами (ITS-1 и ITS-2) (Long and Dawid, 1980).Сходство ITS-последовательностей внутри разных видов выше, чем у разных видов (Elder, Turner, 1995). Это также было показано для стронгайлов, где степень внутривидовой изменчивости была низкой (0–0,3%) по сравнению с межвидовыми различиями (0,6–23,7% для региона ITS-1, 1,3–56,3% для региона ITS-2) ( Hung et al., 1999b).
Ранним подходом к идентификации молекулярных видов на основе локуса ITS-2 является анализ полиморфизма длины рестрикционных фрагментов, связанный с ПЦР (ПЦР-ПДРФ), который впервые был использован для дифференциации одиночных яиц Strongylinae (Campbell et al., 1995), а затем был применен, чтобы показать, что морфологически очень похожие Cylicocyclus ashworthi и Cylicocyclus nassatus на самом деле представляют собой отдельные виды (Hung et al., 1997). Другой метод — это метод однонитевого конформационного полиморфизма, связанный с ПЦР (SSCP-PCR; Gasser and Monti, 1997), который позволяет выделить 14 видов стронгилов, включая 9 циатостоминов, на основе продуктов ПЦР ITS-2 (Hung et al. др., 1999а). Эти методы основаны на ДНК отдельных червей или яиц и, таким образом, связаны с длительными процедурами, если желательно провести скрининг репрезентативного подмножества стронгильного сообщества.
Идентификация видов на основе смешанной ДНК паразитов из образцов фекалий и / или копрокультуры была продемонстрирована после определения последовательностей ITS-2 для 28 видов стронгилов (включая 22 вида циатостомина) и оценки видоспецифичных праймеров для четырех распространенных видов (Hung et al., 1999b). Хотя этот метод теоретически позволяет проводить видоспецифичные исследования объединенных образцов, он ограничивается идентификацией только нескольких видов.
Вариабельность межгенного спейсера 26S-18S рДНК (IGS) была использована для видовой дифференциации 16 видов циатостомина с диапазоном межвидовой изменчивости 31–56% (Kaye et al., 1998). Полученные последовательности использовали для разработки ПЦР-ИФА для идентификации шести распространенных видов циатостомина (Hodgkinson et al., 2003) и анализа методом обратного блоттинга (RLB) для одновременной идентификации 13 видов стронгилов (Traversa et al. , 2007). Оба метода использовались для мониторинга видового состава до и после антигельминтного лечения (Hodgkinson et al., 2005; Čerňanská et al., 2009; Ionita et al., 2010; Traversa et al., 2010). Повторная оценка и проверка существующих и новых олигозондов увеличили количество видов, которые могут быть идентифицированы с помощью RLB, до 18 (Cwiklinski et al., 2012). ПЦР-ИФА и RLB — это качественные методы определения присутствия или отсутствия различных видов. Полуколичественный подход с применением реплик объединенных личинок был положительно оценен, что позволило провести параллельный скрининг многих популяций циатостомина (Kooyman et al., 2016).
Несмотря на то, что митохондриальная субъединица I цитохромоксидазы c (COI), митохондриальная субъединица цитохромоксидазы c I (COI), митохондриальная субъединица цитохромоксидазы c используется для дифференциации видов и может указывать на скрытую видов (Blouin, 2002).Двадцать два гаплотипа последовательностей COI (общая частота внутривидовых нуклеотидных различий 10,8%) были обнаружены в пределах C. nassatus с использованием образцов от разных хозяев и географического происхождения, тогда как в ITS-2 наблюдались лишь незначительные вариации (различия 0,0–0,6%). последовательности, предполагающие криптические виды в пределах C. nassatus (Traversa et al., 2008), а также, возможно, другие морфо-виды циатостомина. Анализ ITS-1 и ITS-2 последовательностей Cylicostephanus minutus особей показал 3.Различия 0 и 7,4% также указывают на присутствие комплекса скрытых видов (Hung et al., 1999a). Комбинация маркеров сомнительных видов оказывается полезной для исследования возникновения комплексов криптических видов.
Принимая во внимание, что цель исследований по идентификации видов циатостомина состоит, с одной стороны, в улучшении доступных диагностических инструментов, с другой стороны, они направлены на содействие пониманию филогенетических отношений между различными таксонами. Таким образом, три локуса гена, ITS-2, COI и 28S рРНК были сравнены на предмет их филогенетической полезности в стронгилах.Было обнаружено, что высокий уровень насыщения заменами делает COI непригодным для филогенетического анализа. Остальные локусы, ITS-2 и 28S рРНК, оба показали сходные группы циатостоминов. Объединение обоих локусов привело к дереву с улучшенной поддержкой начальной загрузки для внутренних узлов (McDonnell et al., 2000), указывающей на важность одновременного применения различных молекулярных маркеров. Это также можно увидеть в исследовании, посвященном анализу последовательностей ITS-1 и ITS-2 30 видов стронгиловых нематод, включая 23 вида циатостомина, которое ставит под сомнение общепринятое разделение Strongylinae и Cyathostominae и предлагает основу для систематического анализа будущих наборов данных о стронгильных нематодах ( Hung et al., 2000). Результаты, согласующиеся с последним филогенетическим анализом, были показаны в исследовании, посвященном роду Cylicocyclus , в котором предлагалось разделить Cylicocyclus на две клады, но статистическая поддержка этой гипотезы была относительно слабой (Bu et al., 2013).
Серологические методы
Циатостоминоз личинок вызывается одновременной реактивацией и появлением большого количества гипобиотических личинок (Love et al., 1999), вызывающих тяжелую патологию.Обычно яйцеклетки не выводятся из-за отсутствия взрослых особей, что делает невозможным копроскопическую диагностику (Murphy and Love, 1997). Это приводит к цели предпатентного выявления инфекций циатостомином с использованием серологии, чтобы иметь возможность оценить риск личиночного циатостоминоза на основе оценки нагрузки циатостомина-червя на слизистую оболочку.
Один многообещающий подход позволил идентифицировать ответы сывороточных антител против личинок IgG (T) на два антигенных комплекса, вызываемых только личинками, в качестве потенциальных маркеров для предпатентных инфекций циатостомином (Dowdall et al., 2002). Последующая очистка природных антигенных комплексов от личинок приводила к более высоким сигналам IgG (T) в ELISA и уменьшала количество ложноположительных ответов (Dowdall et al., 2003). Дополнительное доказательство иммунодиагностического потенциала этих маркеров дается в исследовании, в котором оценивалась нагрузка на слизистые оболочки неопытных и инфицированных лошадей, и было обнаружено, что она значительно коррелирует с уровнями IgG (T) в сыворотке. Кроме того, в сыворотке крови лошадей с клиническим подозрением на циатостоминоз личинок были значительно повышены уровни антиген-специфических IgG (T) (Dowdall et al., 2004). Один антигенный комплекс может быть идентифицирован как циатостомин-ассоциированный с кишечником личиночный антиген-1 (Cy-GALA-1) и отнесен к виду Cyathostomum pateratum (McWilliam et al., 2010) с последующей характеристикой ортологичных антигенов четырех дополнительные общие виды циатостомина. ELISA был разработан на основе рекомбинантных белков Cy-GALA, что позволяет обнаруживать иммунный ответ на личинок циатостомина. Перекрестная реактивность с другими паразитами не наблюдалась и маловероятна из-за разнообразия ортологичных последовательностей GALA нециатостоминных видов (Mitchell et al., 2016). В отсутствие экспериментальных инфекций одного вида сложно оценить перекрестную реактивность между видами циатостомина, поэтому диагностические тесты должны включать панель различных белков Cy-GALA для выявления большинства инфекций циатостомином личинок.
Если в будущем этот подход станет доступным для рутинной диагностики, этот подход может иметь клиническое значение и помочь исключить или подтвердить личиночный циатостоминоз у лошадей с неспецифическими симптомами истощения или колик. Однако из-за отсутствия видоспецифичности серологические методы не помогут получить подробные сведения о роли отдельных видов в личиночном циатостоминозе.
Метод протеомики
Основанная на протеоме матричная лазерная десорбция / ионизация и времяпролетная масс-спектрометрия (профилирование MALDI-TOF MS), идентификация микроорганизмов уже произвела революцию в диагностической микробиологии. Идентификация видов основана на молекулярных массах белков, таких как рибосомные и другие распространенные белки. Небольшое количество микроорганизмов или неочищенных экстрагированных интактных белков переносится на специально разработанные планшеты-мишени и позволяет совместно кристаллизоваться с инертной, поглощающей УФ-излучение матрицей, такой как α-циано-4-гидроксикоричная кислота.Импульсный лазерный луч с длиной волны 337 нм облучает образцы с образованием плотного ионного шлейфа. Полученные ионы ускоряются через вакуумную трубку, чтобы достичь детектора, и разделяются в соответствии с соотношением их заряд / масса ( m / z ), и для каждого измеряется время пролета (TOF). Диапазон масс m / z 2 000–20 000 обычно применяется для идентификации видов путем сопоставления пиков спектра с образцом из базы данных эталонных спектров. Метод популярен благодаря своей рентабельности, надежности и доступности специально разработанных линейных станков MALDI, оснащенных программными инструментами и справочными базами данных.Этот метод был оценен для различных микроорганизмов, таких как бактериальные, грибковые и вирусные патогены (Wieser et al., 2012; Clark et al., 2013). В последние два десятилетия этот метод был разработан для быстрой характеристики линий эукариотических клеток и для дифференциации видов простейших паразитов (например, Leishmania, Giardia ) и членистоногих (например, комаров, клещей, мухи цеце) (Hoppenheit et al. , 2013; Singhal et al., 2016; Yssouf et al., 2016). Что касается нематод, было описано первое диагностическое использование MALDI-TOF для идентификации различных рас Ditylensus dipsaci (Perera et al., 2009) и близкородственные виды нематод корневых узлов и семя-галловых нематод (Perera et al., 2005; Ahmad et al., 2012). Несмотря на эти разработки, обширных исследований по применению MALDI-TOF MS для быстрой идентификации видов гельминтов не проводилось. Недавно MALDI-TOF MS была применена для быстрой видовой идентификации Trichinella spp. после принятия простой экстракции муравьиной кислоты / ацетонитрила из объединенных личинок и составления справочной базы данных (Mayer-Scholl et al., 2016). Этот подход можно также распространить на определение видов циатостомина. Предварительные данные для оценки потенциала MALDI-TOF MS для циатостоминов выявили различные закономерности для взрослых особей разных видов (рис. 1).
Конечно, библиотеки мастер-спектров могут быть созданы только с проверенным, правильно идентифицированным материалом. Это требует, чтобы протеомные данные были получены от морфологически и молекулярно идентифицированного индивидуального образца. Для членистоногих эту проблему можно решить, используя всегда e.g., крыло или ногу для протеомного анализа и любую другую часть тела для молекулярного анализа. Для нематод, которые не сегментированы, это нетривиально, поскольку никакие определенные части тела не могут быть воспроизводимо отрезаны в одном и том же месте без изменения спектра белков. Следовательно, необходимо разработать методы, которые позволяют надежно проводить оба метода с использованием одного и того же исходного материала, несмотря на то, что экстракция белка обычно включает условия, которые повреждают ДНК. Тем не менее, было возможно извлечь ДНК достаточного качества из нерастворимого в ацетонитриле / муравьиной кислоте материала для успешной амплификации и секвенирования области ITS-2 для трех образцов, показанных на рисунке 1.Они на 100, 99 и 97% идентичны номерам доступа Genbank JN786951.2, JN786947.2, JN786949 соответственно, что подтверждает морфологическую идентификацию в каждом случае.
Возможными ограничениями могут быть разные спектры, вызванные разными стадиями развития, как видно при идентификации видов клещей. Однако, несмотря на изменения общих профилей белка MS, клещей можно было правильно классифицировать по определенным специфическим пикам (Karger et al., 2012). Таким образом, характеристика видоспецифичных паттернов пиков, независимо от стадий развития, должна стать частью будущих исследований по внедрению MALDI-TOF MS в качестве возможного диагностического инструмента.
Заключение
В последние десятилетия использовались различные подходы для улучшения определения видов циатостомина. Все методы имеют свои преимущества и ограничения (Таблица 1), и ни один из них уже не дает полного удовлетворения для исследовательских вопросов, на которые необходимо ответить, и все они далеки от применимости в рутинной лабораторной диагностике. Всестороннее исследование различных аспектов улучшения различения отдельных видов циатостомина, таких как включение нескольких молекулярных маркеров и дополнительных протеомных профилей, может оказать большую помощь в будущем.Это должно включать морфологическую идентификацию вместе с описанием данных генотипа (молекулярного) и фенотипа (протеомного) в сочетании с принятой в настоящее время таксономической классификацией. В идеале следует использовать морфологические, молекулярные и протеомные данные одного и того же человека, чтобы воспользоваться всеми тремя подходами для определения полного спектра видов у Cyathostominae и определения их филогенетических взаимоотношений.
Таблица 1 .Сравнение методов видовой идентификации циатостомина.
Авторские взносы
CB провела эксперименты MALDI-TOF и обзоры литературы. CB и JK составили и отредактировали рукопись. ТК предоставила микрофотографии. ТК, Дж.М. и Г.С. участвовали в написании рукописи. CB, JK, JM и GS разработали общий план.
Финансирование
Работа получила финансовую поддержку Deutsche Forschungsgemeinschaft (DFG GRK2046).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Рецензент MN заявил о своем прошлом соавторстве с одним из авторов GvS редактору, который обеспечил соответствие процесса стандартам справедливой и объективной рецензии.
Список литературы
Ахмад Ф., Гопал Дж. И Ву Х. (2012). Быстрое и высокочувствительное обнаружение одиночных нематод с помощью прямой масс-спектрометрии MALDI. Таланта 93, 182–185. DOI: 10.1016 / j.talanta.2012.02.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бевилаква, К.М. Л., Родригес, М., де, Л., и Конкорде, Д. (1993). Выявление инфекционных личинок некоторых обычных стронгилид нематод лошадей. Rev. Med. Вет. 144, 989–995.
Google Scholar
Блуэн, М. С. (2002). Молекулярный поиск криптических видов нематод: митохондриальная ДНК против внутреннего транскрибируемого спейсера. Внутр. J. Parasitol. 32, 527–531. DOI: 10.1016 / S0020-7519 (01) 00357-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брианти, Э., Джаннетто, С., Траверса, Д., Чиргвин, С. Р., Шакья, К., и Клей, Т. Р. (2009). In vitro Развитие личинок циатостомина от личинок третьей стадии до четвертой стадии: морфологическая характеристика, эффекты охлаждения и видоспецифические закономерности. Вет. Паразитол. 163, 348–356. DOI: 10.1016 / j.vetpar.2009.04.029
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бу Ю., Ню Х. и Чжан Л. (2013). Филогенетический анализ рода Cylicocyclus (Nematoda: Strongylidae) на основе данных о последовательности ядерных рибосом. Acta Parasitol. 58, 167–173. DOI: 10.2478 / s11686-013-0124-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кэмпбелл, А. Дж. Д., Гассер, Р. Б., и Чилтон, Н. Б. (1995). Различия в последовательности ДНК рибосом у видов стронгилусов позволяют идентифицировать отдельные яйца. Внутр. J. Parasitol. 25, 359–365. DOI: 10.1016 / 0020-7519 (94) 00116-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чепмен, М. Р., Хатчинсон, Г.W., Cenac, M.J. и Klei, T.R. (1994). In vitro Культура конских стронгилид до четвертой личиночной стадии в бесклеточной среде. J. Parasitol. 80, 225–231. DOI: 10.2307 / 3283751
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чилтон, Н. Б. (2004). Использование ядерных рибосомных ДНК-маркеров для идентификации бурсатных нематод (отряд Strongylida) и для диагностики инфекций. Anim. Лечить. Res. Ред. 5, 173–187.DOI: 10.1079 / AHR200497
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чилтон, Н. Б., Гассер, Р. Б., и Беверидж, И. (1997). Филогенетические отношения австралийских стронгилоидных нематод, выведенные из данных о последовательности рибосомной ДНК. Внутр. J. Parasitol. 27, 1481–1494. DOI: 10.1016 / S0020-7519 (97) 00134-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кларк А. Э., Калета Э. Дж., Арора А. и Волк Д. М. (2013).Матричная лазерная десорбционная ионизация-времяпролетная масс-спектрометрия: фундаментальный сдвиг в повседневной практике клинической микробиологии. Clin. Microbiol. Ред. 26, 547–603. DOI: 10.1128 / CMR.00072-12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цвиклински К., Койман Ф. Н. Дж., Ван Дорн Д. К. К., Мэтьюз Дж. Б. и Ходжкинсон Дж. Э. (2012). Новое понимание вариации последовательности в области IGS 21 вида циатостомина и их значения для молекулярной идентификации. Паразитология 139, 1063–1073. DOI: 10.1017 / S0031182012000467
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Даудалл, С. М. Дж., Мэтьюз, Дж. Б., Майр, Т., Мерфи, Д., Лав, С., и Праудмен, К. Дж. (2002). Антиген-специфические ответы IgG (T) при естественной и экспериментальной инфекции cyathostominae у лошадей. Вет. Паразитол. 106, 225–242. DOI: 10.1016 / S0304-4017 (02) 00085-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Даудалл, С.М. Дж., Праудмен, К. Дж., Клей, Т. Р., Майр, Т., и Мэтьюз, Дж. Б. (2004). Характеристика ответов сывороточных антител IgG (T) на два комплекса личиночных антигенов у лошадей, естественно или экспериментально инфицированных циатостоминами. Внутр. J. Parasitol. 34, 101–108. DOI: 10.1016 / j.ijpara.2003.09.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Даудалл, С. М. Дж., Праудмен, К. Дж., Лав, С., Клей, Т. Р., и Мэтьюз, Дж. Б. (2003). Очистка и анализ специфичности двух предполагаемых диагностических антигенов для личиночной инфекции циатостомина у лошадей. Res. Вет. Sci. 75, 223–229. DOI: 10.1016 / S0034-5288 (03) 00116-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Черняска Д., Паолетти Б., Кралова-Громадова И., Иорио Р., Чудекова П., Милилло П. и др. (2009). Применение метода гибридизации с обратной линией блоттинга для видоспецифической идентификации циатостоминов (Nematoda, Strongylida) от лошадей, получавших бензимидазол, в Словацкой Республике. Вет. Паразитол. 160, 171–174.DOI: 10.1016 / j.vetpar.2008.10.078
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Драдж Дж. Х. и Лайонс Э. Т. (1977). Методы оценки противопаразитарных препаратов лошади. г. J. Vet. Res. 38, 1581–1586.
PubMed Аннотация | Google Scholar
Драдж, Дж. Х., Сзанто, Дж., Вайант, З. Н., и Элам, Г. (1963). Критические испытания тиабендазола как глистогонного средства у лошадей. г. J. Vet. Res. 24, 1217–1222.
PubMed Аннотация | Google Scholar
Двойнос, Г. М., Харченко, В. О. (1994). Стронгилиды диких и домашних лошадей . Киев: Наукова думка.
Гассер, Р. Б., и Ньютон, С. Е. (2000). Геномные и генетические исследования бурсатных нематод: значение, значение и перспективы. Внутр. J. Parasitol. 30, 509–534. DOI: 10.1016 / S0020-7519 (00) 00021-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стадо, р.П. (1990). Изменяющийся мир червей: рост циатостомов и упадок стронгилусов обыкновенных. Компенд. Продолжить. Educ. Практик. Вет. 12, 732–736.
Google Scholar
Ходжкинсон, Дж. Э., Фриман, К. Л., Лихтенфельс, Дж. Р., Палфреман, С., Лав, С., и Мэтьюз, Дж. Б. (2005). Идентификация яиц стронгила от лошадей, получавших антигельминтные средства, с использованием ПЦР-ИФА на основе межгенных последовательностей ДНК. Parasitol. Res. 95, 287–292. DOI: 10.1007 / s00436-004-1289-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ходжкинсон, Дж.E., Lichtenfels, J. R., Mair, T. S., Cripps, P., Freeman, K. L., Ramsey, Y. H., et al. (2003). ПЦР-ИФА для идентификации личинок циатостомина четвертой стадии из клинических случаев личиночного циатостоминоза. Внутр. J. Parasitol. 33, 1427–1435. DOI: 10.1016 / S0020-7519 (03) 00140-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хоппенгейт А., Муругайян Дж., Бауэр Б., Штеубер С., Клаузен П. Х. и Розлер У. (2013). Идентификация цеце ( Glossina spp.) с использованием матричной лазерной десорбции / ионизации времяпролетной масс-спектрометрии. PLoS Negl. Троп. Дис. 7: e2305. DOI: 10.1371 / journal.pntd.0002305
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хунг Г. К., Чилтон Н. Б., Беверидж И. и Гассер Р. Б. (2000). Молекулярная систематическая основа для конских стронгилей, основанная на данных о последовательности рибосомной ДНК. Внутр. J. Parasitol. 30, 95–103. DOI: 10.1016 / S0020-7519 (99) 00166-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хунг, Г.К., Чилтон, Н. Б., Беверидж, И., Макдоннелл, А., Лихтенфельс, Дж. Р., и Гассер, Р. Б. (1997). Молекулярное разграничение Cylicocyclus nassatus и C. ashworthi (Nematoda: Strongylidae). Внутр. J. Parasitol. 27, 601–605. DOI: 10.1016 / S0020-7519 (96) 00192-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хунг, Г. К., Чилтон, Н. Б., Беверидж, И., Чжу, X. К., Лихтенфельс, Дж. Р., и Гассер, Р. Б. (1999a). Молекулярные доказательства криптических видов в пределах Cylicostephanus minutus (Nematoda: Strongylidae). Внутр. J. Parasitol. 29, 285–291. DOI: 10.1016 / S0020-7519 (98) 00203-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хунг, Г. К., Гассер, Р. Б., Беверидж, И., и Чилтон, Н. Б. (1999b). Видоспецифическая амплификация с помощью ПЦР рибосомальной ДНК некоторых конских стронгилей. Parasitol. 119 (Pt 1), 69–80.
PubMed Аннотация | Google Scholar
Ионита, М., Хау, Д. К., Лайонс, Э. Т., Толливер, С. К., Каплан, Р. М., Митреа, И.L., et al. (2010). Использование метода блоттинга с обратной линией для обследования небольших популяций стронгилидов (Strongylida: Cyathostominae) у лошадей до и после лечения ивермектином. Вет. Паразитол. 168, 332–337. DOI: 10.1016 / j.vetpar.2009.11.021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каргер А., Кампен Х., Беттин Б., Даутель Х., Циллер М., Хоффманн Б. и др. (2012). Определение видов и характеристика стадий развития клещей с помощью лазерной десорбционно-ионизационной масс-спектрометрии на всем животном. клещей Tick Borne Dis. 3, 78–89. DOI: 10.1016 / j.ttbdis.2011.11.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кэй, Дж. Н., Лав, С., Лихтенфельс, Дж. Р., и МакКинд, Дж. Б. (1998). Сравнительный анализ последовательности межгенного спейсерного участка циатостомов. Внутр. J. Parasitol. 28, 831–836. DOI: 10.1016 / S0020-7519 (98) 00031-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Харченко В., Кузьмина Т., Trawford, A., Getachew, M., and Feseha, G. (2009). Морфология и диагностика некоторых личинок циатостоминов четвертой стадии (Nematoda: Strongyloidea) ослов Equus asinus L. из Эфиопии. Syst. Паразитол. 72, 1–13. DOI: 10.1007 / s11230-008-9152-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Койман, Ф. Н. Дж., Ван Дорн, Д. К. К., Геурден, Т., и Вагенаар, Дж. А. (2016). Полуколичественная дифференциация культур личинок циатостомина методом обратного блоттинга. Вет. Паразитол. 216, 59–65. DOI: 10.1016 / j.vetpar.2015.12.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Корнась, С., Гавор, Дж., Кабаре, Дж., Моленда, К., Скальска, М., и Новосад, Б. (2009). Морфометрическая идентификация инфекционных личинок циатостома лошадиных (Nematoda: Cyathostominae). Вет. Паразитол. 162, 290–294. DOI: 10.1016 / j.vetpar.2009.03.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кузьмина, Т.А., Харченко В. А., Старовир А. И., Двойнос Г. М. (2005). Анализ сообщества стронгилидных нематод (Nematoda: Strongylidae) после дегельминтизации маточных лошадей в Украине. Вет. Паразитол. 131, 283–290. DOI: 10.1016 / j.vetpar.2005.05.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кузьмина Т.А., Харченко В.О. (2008). Антигельминтная резистентность циатостоминов племенных лошадей в Украине и влияние антигельминтных обработок на структуру сообщества стронгилидов. Вет. Паразитол. 154, 277–288. DOI: 10.1016 / j.vetpar.2008.03.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лихтенфельс, Дж. Р. (1975). Гельминты домашних непарнокопытных. Иллюстрированные определения родов и видов с акцентом на североамериканские формы. Proc. Гельминтол. Soc. Мойка 42, 1–83.
Google Scholar
Лихтенфельс, Дж. Р., Гиббонс, Л. М., и Кречек, Р. К. (2002). Рекомендуемая терминология и достижения в систематике Cyathostominea (Nematoda: Strongyloidea) лошадей. Вет. Паразитол. 107, 337–342. DOI: 10.1016 / S0304-4017 (02) 00167-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лихтенфельс, Дж. Р., Харченко, В. А., Двойнос, Г. М. (2008). Иллюстрированные идентификационные ключи к стронгилидам-паразитам (Strongylidae: Nematoda) лошадей, зебр и ослов (Equidae). Вет. Паразитол. 156, 4–161. DOI: 10.1016 / j.vetpar.2008.04.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лихтенфельс, Дж.Р., Харченко, В. А., Кречек, Р. К., и Гиббонс, Л. М. (1998). Аннотированный контрольный список по родам и видам из 93 названий уровня видов для 51 признанного вида мелких стронгилов (Nematoda: Strongyloidea: Cyathostominea) лошадей, ослов и зебр всего мира. Вет. Паразитол. 79, 65–79. DOI: 10.1016 / S0304-4017 (98) 00149-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лоос, А. (1900). Notizen zur Helminthologie Egypt. III. Die Sclerostomen der Pferde und Esel в Египте. центов. Бактериол. 1, 150–160–192.
Лайонс, Э. Т., Толливер, С. К., и Коллинз, С. С. (2007). Исследование (1991–2001 гг.) Устойчивых к лекарствам малых стронгилей популяции B в критических испытаниях на лошадях в Кентукки по окончании 40-летнего исследования. Parasitol. Res. 101, 689–701. DOI: 10.1007 / s00436-007-0535-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Lyons, E. T., Tolliver, S. C., and Drudge, J. (1999). Историческая перспектива циатостомов: распространенность, программы лечения и контроля. Вет. Паразитол. 85, 97–112. DOI: 10.1016 / S0304-4017 (99) 00091-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лайонс, Э. Т., Толливер, С. К., Кузьмина, Т. А., и Коллинз, С. С. (2010). Критические тесты, оценивающие эффективность моксидектина против небольших стронгилей у лошадей из стада, для которых в полевых испытаниях в Центральном Кентукки была обнаружена пониженная активность. Parasitol. Res. 107, 1495–1498. DOI: 10.1007 / s00436-010-2025-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Майер-Шолль, А., Муругайян, Дж., Нойман, Дж., Бан, П., Рекингер, С., и Нёклер, К. (2016). Быстрая идентификация возбудителя пищевого происхождения Trichinella spp. с помощью матричной лазерной десорбционно-ионизационной масс-спектрометрии. PLoS ONE 11: e0152062. DOI: 10.1371 / journal.pone.0152062
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Макдоннелл, А., Лав, С., Тейт, А., Лихтенфельс, Дж. Р., и Мэтьюз, Дж. Б. (2000). Филогенетический анализ частичной митохондриальной субъединицы c цитохромоксидазы I и последовательностей больших рибосомных РНК и ядерных внутренних транскрибированных последовательностей спейсера I из видов Cyathostominae и Strongylinae (Nematoda, отряд Strongylida), паразитов лошади. Паразитология 121, 649–659. DOI: 10,1017 / s003118200000696x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маквильям Х. Э. Г., Нисбет А. Дж., Даудалл С. М. Дж., Ходжкинсон Дж. Э. и Мэтьюз Дж. Б. (2010). Идентификация и характеристика иммунодиагностического маркера личинок на стадии развития циатостомина. Внутр. J. Parasitol. 40, 265–275. DOI: 10.1016 / j.ijpara.2009.08.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Митчелл, М.C., Tzelos, T., Handel, I., McWilliam, H.E.G., Hodgkinson, J.E., Nisbet, A.J., et al. (2016). Разработка ИФА на основе рекомбинантных белков для диагностики личиночной инфекции циатостомином. Паразитология 143, 1055–1066. DOI: 10.1017 / S0031182016000627
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Молин Р. (1861). Il sottordine degli acrofalli ordinato scientificamente secondo i risultamenti delle indagini anatomiche ed embrigeniche. Mem.R. Ist. Veneto Sc. Lett Arti 9, 427–633.
Google Scholar
Нильсен, М. К., Райнемейер, К. Р., Донекер, Дж. М., Литвик, Д. М., Маркиондо, А. А. и Каплан, Р. М. (2014). Устойчивость к глистогонам у паразитов лошадей — Текущие данные и пробелы в знаниях. Вет. Паразитол. 204, 55–63. DOI: 10.1016 / j.vetpar.2013.11.030
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Остерман Линд, Э., Эйскер, М., Нильссон, О., Уггла, А.и Хёглунд Дж. (2003). Изгнание мелких стронгиловых нематод (cyathostomin spp) после дегельминтизации лошадей на конезаводе в Швеции. Вет. Паразитол. 115, 289–299. DOI: 10.1016 / S0304-4017 (03) 00200-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Перера М. Р., Ванстон В. А. и Джонс М. Г. (2005). Новый подход к идентификации нематод, паразитирующих в растениях, с использованием времяпролетной масс-спектрометрии с лазерной десорбцией и ионизацией с использованием матрицы. Rapid Commun.Масс-спектрометрия. 19, 1454–1460. DOI: 10.1002 / RCM.1943
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Перера М., Тейлор С., Джонс М. и Ванстон В. (2009). Белковые биомаркеры для различения овсяной и люцерновой рас стеблевой нематоды Ditylenchus dipsaci, имеющих карантинное значение для Западной Австралии. Нематология 11, 555–563. DOI: 10.1163 / 138855409X12465362560557
CrossRef Полный текст | Google Scholar
Сантос, Д.В., Диас де Кастро, Л. Л., Гизе, Э. Г., и Моленто, М. Б. (2016). Морфометрическое исследование инфекционных личинок циатостоминов лошадей и их распространение. J. Equine Vet. Sci. 44, 49–53. DOI: 10.1016 / j.jevs.2016.02.237
CrossRef Полный текст | Google Scholar
Сингхал Н., Кумар М. и Вирди Дж. С. (2016). MALDI-TOF MS в клинической паразитологии: приложения, ограничения и перспективы. Паразитология 143, 1491–1500. DOI: 10.1017 / S0031182016001189
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Смит, Дж.Д. (1990). Выращивание паразитических гельминтов in vitro . Бока-Ратон, Флорида: CRC Press Inc.
Google Scholar
Толливер, С. К. (2000). Практический метод идентификации североамериканских Cyathostomes (Small Strongyles) у лошадей в Кентукки . Лексингтон: Университет Кентукки, факультет ветеринарии.
Google Scholar
Траверса Д., Иорио Р., Клей Т. Р., Харченко В. А., Гавор Дж., Отранто Д. и др. (2007).Новый метод одновременной видоспецифической идентификации конских стронгилов (нематоды, стронгилиды) с помощью блот-гибридизации с обратной линией. J. Clin. Microbiol. 45, 2937–2942. DOI: 10.1128 / JCM.00714-07
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Траверса, Д., Кузьмина, Т., Харченко, В. А., Иорио, Р., Клей, Т. Р., Отранто, Д. (2008). Гаплотипическая изменчивость внутри митохондриального гена, кодирующего цитохром с оксидазу 1 (cox1) Cylicocyclus nassatus (Nematoda, Strongylida): свидетельство принадлежности паразитарных популяций к хозяевам домашних и диких непарнокопытных. Вет. Паразитол. 156, 241–247. DOI: 10.1016 / j.vetpar.2008.05.031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Traversa, D., Milillo, P., Barnes, H., von Samson-Himmelstjerna, G., Schurmann, S., Demeler, J., et al. (2010). Распространение и видоспецифическая встречаемость циатостоминов (Nematoda, Strongylida) у естественно инфицированных лошадей из Италии, Великобритании и Германии. Вет. Паразитол. 168, 84–92. DOI: 10.1016 / j.vetpar.2009.10.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фон Самсон-Химмельстьерна, Г. (2012). Устойчивость к глистогонам у паразитов лошадей — выявление, потенциальная клиническая значимость и значение для борьбы. Вет. Паразитол. 185, 2–8. DOI: 10.1016 / j.vetpar.2011.10.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Визер А., Шнайдер Л., Юнг Дж. И Шуберт С. (2012). MALDI-TOF MS в микробиологической диагностике-идентификации микроорганизмов и за ее пределами (мини-обзор). заявл. Microbiol. Biotechnol. 93, 965–974. DOI: 10.1007 / s00253-011-3783-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Yssouf, A., Socolovschi, C., Flaudrops, C., Ndiath, M.O., Sougoufara, S., Dehecq, J. S., et al. (2013). Матричная лазерная десорбционная ионизация — времяпролетная масс-спектрометрия: новый инструмент для быстрой идентификации комаров-переносчиков. PLoS ONE 8: e72380. DOI: 10.1371 / journal.pone.0072380
PubMed Аннотация | CrossRef Полный текст | Google Scholar
ADW: Nematoda: INFORMATION
Круглые черви (нематоды) — это двусторонне симметричные червеобразные организмы, окруженные прочным гибким неклеточным слоем, называемым кутикулой.План их тела прост. Кутикула секретируется слоем эпидермальных клеток и покрывает их. Рядом со стенкой тела, но под клетками эпидермиса находятся мышечные клетки; они идут только в продольном направлении. Настоящего целома нет, вместо этого у нематод есть «псевдоцель», образованный непосредственно из полости бластулы (а не в результате деления или складывания мезодермы). Полость псевдоцикла небольшая, в основном заполнена кишечником и яйцеводами или семенниками. Простая нервная система состоит из кольца нервной ткани вокруг глотки, которое дает начало спинным и брюшным нервным связкам, проходящим по всей длине тела.
Нематоды передвигаются за счет сокращения продольных мышц. Поскольку их внутреннее давление велико, это заставляет тело скорее сгибаться, чем сгибаться, и животное движется, раскачиваясь взад и вперед. Реснички и жгутики отсутствуют.
У некоторых нематод есть специализированные клетки, выделяющие азотсодержащие отходы; в других — каналы или каналы плюс эти специализированные клетки. У нематод нет клеток пламени.
Большинство нематод раздельнополы.Оплодотворение происходит, когда самцы используют специальные копулятивные шипы, чтобы открыть репродуктивные тракты самок и ввести в них сперму. Сперма уникальна тем, что у нее нет жгутиков и она движется псевдоподиями, как амебы. Развитие оплодотворенных яиц обычно прямое.
Нематоды невероятно многочисленны. В одном исследовании сообщалось о
отдельных нематод в одном гниющем яблоке. Другой сообщил о 236 видах, обитающих в нескольких кубических сантиметрах грязи.Число описанных видов составляет около 12 000, но этим животным уделяется слишком мало внимания, и истинное число может быть ближе к 500 000. Некоторые виды являются универсальными, встречаются на обширных территориях и во многих местообитаниях; другие гораздо более специализированы. Нематоды заселили почти все мыслимые места обитания на земле, включая такие маловероятные места, как под пивными подставками в Германии (Panagrellus redivivus). Некоторые нематоды также являются экстремальными специалистами по средам обитания, живя, например, только в плаценте кашалотов (Placentonema gigantissima) или в правой почке норок (Dioctophyme renale)
Многие нематоды живут свободно и играют важную экологическую роль в качестве разложителей и хищников микроорганизмов.Но нематоды также включают паразитические виды, некоторые из которых прямо или косвенно поражают людей через своих домашних животных. К ним относятся обычные круглые черви, которыми, вероятно, заражено более половины людей в мире; анкилостомы; трихинеллез — глисты, вызывающие трихинеллез; острицы, еще один чрезвычайно распространенный паразит, даже в Соединенных Штатах, который может передаваться от человека к человеку через яйца, плавающие в домашней пыли; и нитчатые черви, в первую очередь тропические паразиты, вызывающие такие заболевания, как филяриатоз (слоновость) и онхоцеркоз (речная слепота).
Источник :
Hickman, C.P. и Л. С. Робертс. 1994. Разнообразие животных . Wm. К. Браун, Dubuque, IA.
Brusca, R. C., and G. J. Brusca. Беспозвоночные. 1990. Sinauer Associates, Сандерленд, Массачусетс.
Chandler, A.C. 1961. Введение в паразитологию. Джон Вили и сыновья, Нью-Йорк.
Ли, Д.Л. и Х.Дж. Аткинсон.1976. Физиология нематод (2-е изд.). Издательство Колумбийского университета, Нью-Йорк.
Авторы
Фил Майерс (автор), Музей зоологии, Мичиганский университет в Анн-Арборе.
Идентификация видов нематод — текущее состояние, проблемы и перспективы развития циатостоминов
Front Cell Infect Microbiol. 2017; 7: 283.
Кристина М. Бредтманн
1 Отделение ветеринарной медицины, Институт паразитологии и тропической ветеринарии, Свободный университет Берлина, Берлин, Германия
Юрген Крюкен
1 Отдел ветеринарной медицины, Институт отделения паразитологии и тропической ветеринарии, Свободный университет Берлина, Берлин, Германия
Джаясилан Муругайян
2 Отдел ветеринарной медицины, Институт гигиены животных и окружающей среды, Свободный университет Берлина, Берлин, Германия
Татьяна Кузьмина
3 Кафедра паразитологии, И.Институт зоологии им. И. Шмальгаузена, Киев, УкраинаГеорг фон Самсон-Химмельстьерна
1 Кафедра ветеринарной медицины, Институт паразитологии и тропической ветеринарии, Свободный университет Берлина, Берлин, Германия
1 Ветеринарное отделение Медицина, Институт паразитологии и тропической ветеринарии, Свободный университет Берлина, Берлин, Германия
2 Отделение ветеринарной медицины, Институт гигиены животных и окружающей среды, Свободный университет Берлина, Берлин, Германия
3 Отделение паразитологии , И.Институт зоологии им. И. Шмальгаузена, Киев, Украина
Отредактировал: Лилах Шейнер, Центр молекулярной паразитологии Wellcome Trust, Великобритания
Рецензент: Элиас Пападопулос, Университет Аристотеля в Салониках, Греция; Мартин Краруп Нильсен, Университет Кентукки, США
Поступило 31 марта 2017 г .; Принято, 2017 г. 12 июня.
Copyright © 2017 Бредтманн, Крюкен, Муругайян, Кузьмина и фон Самсон-Химмельстьерна.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (CC BY).Использование, распространение или воспроизведение на других форумах разрешено при условии указания автора (авторов) или лицензиара и ссылки на оригинальную публикацию в этом журнале в соответствии с принятой академической практикой. Запрещается использование, распространение или воспроизведение без соблюдения этих условий.
Эта статья цитируется в других статьях в PMC.Abstract
На здоровье человека и животных во всем мире влияют различные паразитические гельминты. Воздействие сопутствующих инфекций и развитие устойчивости к глистогонам требует усовершенствованных диагностических инструментов, особенно для паразитарных нематод. E.g., чтобы идентифицировать устойчивые виды или приписывать патологические эффекты отдельным видам или конкретным комбинациям видов. У лошадей коинфекция циатостоминами является скорее правилом, чем исключением, обычно от 5 до 15 видов (из более чем 40 описанных) на отдельного хозяина. У циатостоминов надежная морфологическая дифференциация видов в настоящее время ограничена взрослыми особями и требует высокоспециализированной экспертизы, в то время как точная морфологическая идентификация яиц и личинок на ранних стадиях невозможна.Ситуация дополнительно осложняется сомнительной достоверностью некоторых циатостоминов, в то время как другие могут фактически представлять собой комплексы криптических видов. Для преодоления этих ограничений было разработано несколько молекулярных методов с использованием различных целевых последовательностей. Для взрослых червей ПЦР с последующим секвенированием митохондриальных генов или внешних или внутренних спейсеров рибосомной РНК подходит для генетического подтверждения морфологической идентификации. Наиболее часто используемый метод дифференциации яиц или личинок — это анализ гибридизации с обратной линией и блоттингом.Однако оба метода страдают от того факта, что последовательности-мишени недоступны для многих видов или даже из-за того, что записи GenBank® ненадежны в отношении видов циатостомина. Последние достижения в области протеомных инструментов для идентификации многоклеточных животных, включая насекомых и нематод из рода Trichinella , будут оценены на предмет пригодности для диагностики циатостоминов. Дальнейшие исследования должны быть сосредоточены на сравнительном анализе морфологических, молекулярных и протеомных данных одного и того же образца циатостомина с целью оптимизации инструментов для видоспецифической идентификации.
Ключевые слова: циатостомины, нематоды, диагностика, ПЦР, MALDI-TOF MS
Введение
Паразитические гельминты во всем мире влияют на здоровье человека и животных и могут иметь зоонозное значение (например, Ascaris spp.). У лошадей наиболее важные кишечные нематоды принадлежат к семейству Strongylidae и состоят из двух подсемейств: Strongylinae, включающих 14 видов в 5 родов ( Strongylus, Oesophagodontus, Triodontophorus, Bidentostomum и Craterostomum Cycompathostomum в настоящее время), и 50 допустимых видов в 14 родах ( Caballonema, Coronocyclus, Cyathostomum, Cylicocyclus, Cylicodontophorus, Cylicostephanus, Cylindropharynx, Gyalocephalus, Hsiungia, Parapoteriostomum, Petrovinema, Poteriostomum, Scrjibridentich45), 2008), в отличие от предыдущих публикаций, перечисляющих 51 или 52 вида в 13 родах (Lichtenfels, 1975; Lichtenfels et al., 2002). В литературе термин «маленькие стронгилы» был введен для обозначения только Cyathostominae или всех конских стронгилид, за исключением рода Strongylus , которые были обозначены как «большие стронгилы» (Lyons et al., 1999). Несмотря на то, что он все еще широко используется, в настоящее время рекомендуется избегать терминов малый и большой стронгилы (Lichtenfels et al., 2002).
Поскольку распространенность высокопатогенных видов Strongylus снизилась после введения макроциклических лактонов (Herd, 1990), циатостомины в настоящее время признаны наиболее важными паразитами лошадей из-за (i) их распространенности до 100% среди лошадиных ( Lyons et al., 1999), (ii) многочисленные сообщения об устойчивости к глистогонам и (iii) их патогенность, которая особенно проявляется в случаях иногда летального личиночного циатостоминоза (Love et al., 1999). Устойчивость к глистогонам к бензимидазолам широко распространена во всем мире, также часто наблюдается устойчивость к пирантелу, тогда как о снижении эффективности макроциклических лактонов сообщалось редко (Kaplan, 2002; Kuzmina and Kharchenko, 2008; Von Samson-Himmelstjerna, 2012; Matthews, 2014; Nielsen et al. ., 2014).
Циатостомыны имеют прямой жизненный цикл со взрослыми особями, расположенными в просвете слепой и толстой кишки, выделяя яйца с фекалиями. Первые личинки (L1) вылупляются с фекалиями, дважды линяют до инфекционных третьих личинок (L3), которые поедаются непарными. В толстом кишечнике L3 энцистирует внутри кишечной стенки и может также претерпевать гипобиоз в течение нескольких месяцев, прежде чем линька до четвертой личинки (L4) (Corning, 2009). Синхронная эксцистация большого количества личинок гипобиотов потенциально вызывает циатостоминоз личинок, характеризующийся тяжелым воспалением, приводящим к потере веса, диарее, коликам или даже смерти (Love et al., 1999).
Хотя циатостомины представляют угрозу благополучию лошадей, и часто предпринимаются научные усилия для решения этой проблемы, исследования затрудняются из-за отсутствия достаточных методов идентификации (Lichtenfels, 2008). Эта перспектива касается различных методов, их преимуществ и ограничений и дает представление о возможных будущих методах идентификации нематод с использованием циатостоминов в качестве парадигмы.
Пробы и отбор проб
Первой проблемой при идентификации видов является наличие подходящих образцов.Хотя яйца стронгилидов можно легко собрать из фекалий, они практически не имеют диагностически полезных морфологических особенностей. Стронгилид L3 можно получить из яиц с использованием различных методов культивирования фекалий (Smyth, 1990). Однако только некоторые L3 могут быть идентифицированы до уровня рода, и это требует высокого уровня опыта. Только для нескольких видов in vitro была описана культура для L4 (Chapman et al., 1994; Brianti et al., 2009). Следовательно, взрослых паразитов необходимо собирать у естественно инфицированных хозяев.У лошадей лишь несколько взрослых стронгилов иногда выделяются с фекалиями, но сбор взрослых нематод из фекалий после антигельминтной обработки возможен (Osterman Lind et al., 2003; Кузьмина и др., 2005; Кузьмина, Харченко, 2008). Тем не менее, полная нагрузка червей, представляющая все виды живой лошади, может быть задокументирована только путем исследования всех фекалий в течение нескольких дней, что может быть связано с деградацией червей, что приведет к искаженным результатам. Более точным и значимым методом является сбор взрослых нематод из содержимого кишечника лошади (Drudge, Lyons, 1977).Критический метод испытаний, который подробно описан Drudge et al. (1963), представляет собой комбинацию как сбора кала в течение недели, так и сбора во время вскрытия трупа. Этот метод широко используется для изучения эффективности глистогонных соединений (например, Lyons et al., 2007, 2010). Из-за необходимости приносить в жертву или забивать лошадей эти методы ограничены исследованиями. Таким образом, существует большая потребность в разработке альтернатив для точной диагностики нематод у живых лошадей. Поэтому ближайшей целью исследования является разработка эффективных и специфических неинвазивных методов идентификации циатостомина.
Морфологическая идентификация
За более чем 100 лет (Molin, 1861; Loos, 1900) большое количество видов циатостомина было морфологически описано с использованием 93 различных названий. Между тем, несколько ранее описанных видов считаются синонимами (Lichtenfels et al., 1998), а в настоящее время 50 видов признаны действительными. Были опубликованы исчерпывающие идентификационные ключи, обобщающие описания (Lichtenfels, 1975; Tolliver, 2000; Lichtenfels et al., 2008).
Морфологическая идентификация взрослых стронгилей основывается на тщательном изучении слабых признаков на переднем конце взрослых нематод или репродуктивной системы. Эти черты включают размер и форму буккальных капсул, внутренних и внешних коронок листа и его дополнительную хитиновую опору, как показано на рисунке, чтобы указать на очень слабые различия. Тонкие морфологические структуры заднего конца, такие как размер и форма бурсы, генитального конуса, губернакула и спикул у самцов, а также форма хвоста, размер и соотношение различных частей репродуктивной системы у самок также имеют важное значение для дифференциации видов (Lichtenfels , 1975; Двойнос, Харченко, 1994; Lichtenfels et al., 2008). Однако надежная морфологическая идентификация взрослых циатостоминов может быть достигнута только после нескольких лет интенсивного обучения, и в настоящее время во всем мире доступно лишь несколько экспертов (Lichtenfels et al., 2008).
Сравнение методов морфологической и протеомной идентификации видов. Передние концы и репрезентативные спектры MALDI-TOF MS трех видов циатостомина из близкородственных видов (A) Coronocyclus коронатус , (B) Coronocyclus labiatus и (C) Coronocyclus labratus .Масштабные линейки представляют 100 мкм. Оси x показывают отношения массовых зарядов, а оси y представляют собой произвольные единицы интенсивности. Спектры вычитали и сглаживали с использованием параметров по умолчанию в программном обеспечении flexAnalysis (Bruker Daltonics). Образцы очищали лактофенолом для улучшения видимости структурных особенностей кутикулы. Наружная и внутренняя листовая крона обозначены черными и белыми стрелками соответственно.
Принимая во внимание, что взрослые циатостомины можно различить, яйца L1 и L2 нельзя отличить от других нематод семейства Strongylidae.Идентификация L3 возможна для некоторых родов, таких как Strongylus, Triodontophorus, Gyalocephalus или Poteriostomum , в то время как большинство других можно отнести только к нескольким типам личинок циатостомина (Bevilaqua et al., 1993; Santos et al., 2016). Морфологические особенности включают качественные и количественные признаки, такие как количество, расположение и форма клеток кишечника / средней кишки, длина кишечника и длина оболочки хвоста.
Молекулярные методы
Чтобы преодолеть ограничения морфологической идентификации, исследования были сосредоточены на молекулярной идентификации циатостомина.Эти методы, после правильной реализации целевых последовательностей, могут применяться независимо от стадии жизни нематод.
Целевым локусом, который оказался полезным для разработки генетических маркеров для диагностических и филогенетических целей, является рибосомная ДНК (рДНК) (обзор Gasser and Newton, 2000; Chilton, 2004). Ядерная рДНК эукариот организована в кластеры, иногда из нескольких сотен повторов. Кодирующие последовательности для 18S, 5.8S и 28S рРНК прерываются первым и вторым внутренне транскрибируемыми спейсерами (ITS-1 и ITS-2) (Long and Dawid, 1980).Сходство ITS-последовательностей внутри разных видов выше, чем у разных видов (Elder, Turner, 1995). Это также было показано для стронгайлов, где степень внутривидовой изменчивости была низкой (0–0,3%) по сравнению с межвидовыми различиями (0,6–23,7% для региона ITS-1, 1,3–56,3% для региона ITS-2) ( Hung et al., 1999b).
Ранним подходом к идентификации молекулярных видов на основе локуса ITS-2 является анализ полиморфизма длины рестрикционных фрагментов, связанный с ПЦР (ПЦР-ПДРФ), который впервые был использован для дифференциации одиночных яиц Strongylinae (Campbell et al., 1995), а затем был применен, чтобы показать, что морфологически очень похожие Cylicocyclus ashworthi и Cylicocyclus nassatus на самом деле представляют собой отдельные виды (Hung et al., 1997). Другой метод — это метод однонитевого конформационного полиморфизма, связанный с ПЦР (SSCP-PCR; Gasser and Monti, 1997), который позволяет выделить 14 видов стронгилов, включая 9 циатостоминов, на основе продуктов ПЦР ITS-2 (Hung et al. др., 1999а). Эти методы основаны на ДНК отдельных червей или яиц и, таким образом, связаны с длительными процедурами, если желательно провести скрининг репрезентативного подмножества стронгильного сообщества.
Идентификация видов на основе смешанной ДНК паразитов в образцах фекалий и / или копрокультурах была продемонстрирована после определения последовательностей ITS-2 для 28 видов стронгилов (включая 22 вида циатостомина) и оценки видоспецифичных праймеров для четырех распространенных видов (Hung et al. , 1999b). Хотя этот метод теоретически позволяет проводить видоспецифичные исследования объединенных образцов, он ограничивается идентификацией только нескольких видов.
Вариабельность межгенного спейсера 26S-18S рДНК (IGS) была использована для видовой дифференциации 16 видов циатостомина с диапазоном межвидовой изменчивости 31–56% (Kaye et al., 1998). Полученные последовательности использовали для разработки ПЦР-ИФА для идентификации шести распространенных видов циатостомина (Hodgkinson et al., 2003) и анализа методом обратного блоттинга (RLB) для одновременной идентификации 13 видов стронгилов (Traversa et al. , 2007). Оба метода использовались для мониторинга видового состава до и после антигельминтного лечения (Hodgkinson et al., 2005; Čerňanská et al., 2009; Ionita et al., 2010; Traversa et al., 2010). Повторная оценка и проверка существующих и новых олигозондов увеличили количество видов, которые могут быть идентифицированы с помощью RLB, до 18 (Cwiklinski et al., 2012). ПЦР-ИФА и RLB — это качественные методы определения присутствия или отсутствия различных видов. Полуколичественный подход с применением реплик объединенных личинок был положительно оценен, что позволило провести параллельный скрининг многих популяций циатостомина (Kooyman et al., 2016).
Несмотря на то, что митохондриальная субъединица I цитохромоксидазы c (COI), митохондриальная цитохромоксидаза c-субъединица I (COI), используется для дифференциации видов и может указывать на криптический вид (Blouin, 2002).Двадцать два гаплотипа последовательностей COI (общая частота внутривидовых нуклеотидных различий 10,8%) были обнаружены в пределах C. nassatus с использованием образцов от разных хозяев и географического происхождения, тогда как в ITS-2 наблюдались лишь незначительные вариации (различия 0,0–0,6%). последовательности, предполагающие криптические виды в пределах C. nassatus (Traversa et al., 2008), а также, возможно, другие морфо-виды циатостомина. Анализ последовательностей ITS-1 и ITS-2 у Cylicostephanus minutus особей показал 3.Различия 0 и 7,4% также указывают на присутствие комплекса скрытых видов (Hung et al., 1999a). Комбинация маркеров сомнительных видов оказывается полезной для исследования возникновения комплексов криптических видов.
Принимая во внимание, что цель исследования по идентификации видов циатостомина состоит, с одной стороны, в улучшении доступных диагностических инструментов, с другой стороны, оно направлено на содействие пониманию филогенетических отношений между различными таксонами. Таким образом, три локуса гена, ITS-2, COI и 28S рРНК были сравнены на предмет их филогенетической полезности в стронгилах.Было обнаружено, что высокий уровень насыщения заменами делает COI непригодным для филогенетического анализа. Остальные локусы, ITS-2 и 28S рРНК, оба показали сходные группы циатостоминов. Объединение обоих локусов привело к дереву с улучшенной поддержкой начальной загрузки для внутренних узлов (McDonnell et al., 2000), указывающей на важность одновременного применения различных молекулярных маркеров. Это также можно увидеть в исследовании, посвященном анализу последовательностей ITS-1 и ITS-2 30 видов стронгиловых нематод, включая 23 вида циатостомина, которое ставит под сомнение общепринятое разделение Strongylinae и Cyathostominae и предлагает основу для систематического анализа будущих наборов данных о стронгильных нематодах ( Hung et al., 2000). Результаты, согласующиеся с последним филогенетическим анализом, были показаны в исследовании, посвященном роду Cylicocyclus , в котором предлагалось разделить Cylicocyclus на две клады, но статистическая поддержка этой гипотезы была относительно слабой (Bu et al., 2013).
Серологические методы
Циатостоминоз личинок вызывается одновременной реактивацией и появлением большого количества гипобиотических личинок (Love et al., 1999), вызывающих тяжелую патологию.Обычно яйцеклетки не выводятся из-за отсутствия взрослых особей, что делает невозможным копроскопическую диагностику (Murphy and Love, 1997). Это приводит к цели предпатентного выявления инфекций циатостомином с использованием серологии, чтобы иметь возможность оценить риск личиночного циатостоминоза на основе оценки нагрузки циатостомина-червя на слизистую оболочку.
Один многообещающий подход позволил идентифицировать реакции сывороточных антител против личинок IgG (T) на два антигенных комплекса, вызываемых только личинками, в качестве потенциальных маркеров для предпатентных инфекций циатостомином (Dowdall et al., 2002). Последующая очистка природных антигенных комплексов от личинок приводила к более высоким сигналам IgG (T) в ELISA и уменьшала количество ложноположительных ответов (Dowdall et al., 2003). Дополнительное доказательство иммунодиагностического потенциала этих маркеров дается в исследовании, в котором оценивалась нагрузка на слизистые оболочки неопытных и инфицированных лошадей, и было обнаружено, что она значительно коррелирует с уровнями IgG (T) в сыворотке. Кроме того, в сыворотке крови лошадей с клиническим подозрением на циатостоминоз личинок были значительно повышены уровни антиген-специфических IgG (T) (Dowdall et al., 2004). Один антигенный комплекс может быть идентифицирован как циатостомин-ассоциированный с кишечником личиночный антиген-1 (Cy-GALA-1) и отнесен к виду Cyathostomum pateratum (McWilliam et al., 2010) с последующей характеристикой ортологичных антигенов четырех дополнительные общие виды циатостомина. ELISA был разработан на основе рекомбинантных белков Cy-GALA, что позволяет обнаруживать иммунный ответ на личинок циатостомина. Перекрестная реактивность с другими паразитами не наблюдалась и маловероятна из-за разнообразия ортологичных последовательностей GALA нециатостоминных видов (Mitchell et al., 2016). В отсутствие экспериментальных инфекций одного вида сложно оценить перекрестную реактивность между видами циатостомина, поэтому диагностические тесты должны включать панель различных белков Cy-GALA для выявления большинства инфекций циатостомином личинок.
Если в будущем этот подход станет доступным для рутинной диагностики, этот подход может иметь клиническое значение и помочь исключить или подтвердить личиночный циатостоминоз у лошадей с неспецифическими симптомами истощения или колик. Однако из-за отсутствия видоспецифичности серологические методы не помогут получить подробные сведения о роли отдельных видов в личиночном циатостоминозе.
Протеомический метод
Метод определения микроорганизмов с помощью матричной лазерной десорбции / ионизации и времяпролетной масс-спектрометрии (профилирование MALDI-TOF) уже произвел революцию в диагностической микробиологии. Идентификация видов основана на молекулярных массах белков, таких как рибосомные и другие распространенные белки. Небольшое количество микроорганизмов или неочищенных экстрагированных интактных белков переносится на специально разработанные планшеты-мишени и позволяет совместно кристаллизоваться с инертной, поглощающей УФ-излучение матрицей, такой как α-циано-4-гидроксикоричная кислота.Импульсный лазерный луч с длиной волны 337 нм облучает образцы с образованием плотного ионного шлейфа. Полученные ионы ускоряются через вакуумную трубку для достижения детектора и разделяются в соответствии с отношением их заряд / масса ( m / z ), и для каждого измеряется время пролета (TOF). Диапазон масс m / z 2 000–20 000 обычно применяется для идентификации видов путем сопоставления пиков спектра с образцом из базы данных эталонных спектров. Метод популярен благодаря своей рентабельности, надежности и доступности специально разработанных линейных станков MALDI, оснащенных программными инструментами и справочными базами данных.Этот метод был оценен для различных микроорганизмов, таких как бактериальные, грибковые и вирусные патогены (Wieser et al., 2012; Clark et al., 2013). В последние два десятилетия этот метод был разработан для быстрой характеристики линий эукариотических клеток и для дифференциации видов простейших паразитов (например, Leishmania , Giardia ) и членистоногих (например, комаров, клещей, мухи цеце) (Hoppenheit et al. , 2013; Singhal et al., 2016; Yssouf et al., 2016). Что касается нематод, первое диагностическое использование MALDI-TOF было описано для идентификации различных рас Ditylensus dipsaci (Perera et al., 2009) и близкородственные виды нематод корневых узлов и семя-галловых нематод (Perera et al., 2005; Ahmad et al., 2012). Несмотря на эти разработки, обширных исследований по применению MALDI-TOF MS для быстрой идентификации видов гельминтов не проводилось. Недавно MALDI-TOF MS была применена для быстрой видовой идентификации Trichinella spp. после принятия простой экстракции муравьиной кислоты / ацетонитрила из объединенных личинок и составления справочной базы данных (Mayer-Scholl et al., 2016). Этот подход можно также распространить на определение видов циатостомина. Предварительные данные для оценки потенциала MALDI-TOF MS для циатостоминов выявили различные закономерности для взрослых особей разных видов (рисунок).
Конечно, библиотеки мастер-спектров могут быть созданы только с проверенным, правильно идентифицированным материалом. Это требует, чтобы протеомные данные были получены от морфологически и молекулярно идентифицированного индивидуального образца. Для членистоногих эту проблему можно решить, используя всегда e.g., крыло или ногу для протеомного анализа и любую другую часть тела для молекулярного анализа. Для нематод, которые не сегментированы, это нетривиально, поскольку никакие определенные части тела не могут быть воспроизводимо отрезаны в одном и том же месте без изменения спектра белков. Следовательно, необходимо разработать методы, которые позволяют надежно проводить оба метода с использованием одного и того же исходного материала, несмотря на то, что экстракция белка обычно включает условия, которые повреждают ДНК. Тем не менее, было возможно извлечь ДНК достаточного качества из нерастворимого в ацетонитриле / муравьиной кислоте материала для успешной амплификации и секвенирования области ITS-2 для трех образцов, показанных на рисунке.Они были на 100, 99 и 97% идентичны номерам доступа Genbank {«type»: «entrez-nucleotide», «attrs»: {«text»: «JN786951.2», «term_id»: «379317007», «term_text «:» JN786951.2 «}} JN786951.2, {» type «:» entrez-нуклеотид «,» attrs «: {» text «:» JN786947.2 «,» term_id «:» 379317003 «,» term_text » : «JN786947.2»}} JN786947.2, {«type»: «entrez-нуклеотид», «attrs»: {«text»: «JN786949», «term_id»: «379317005», «term_text»: «JN786949 «}} JN786949 соответственно, что подтвердило морфологическую идентификацию в каждом случае.
Возможными ограничениями могут быть разные спектры, вызванные разными стадиями развития, как видно при идентификации видов клещей.Однако, несмотря на изменения общих профилей белка MS, клещей можно было правильно классифицировать по определенным специфическим пикам (Karger et al., 2012). Таким образом, характеристика видоспецифичных паттернов пиков, независимо от стадий развития, должна стать частью будущих исследований по внедрению MALDI-TOF MS в качестве возможного диагностического инструмента.
Заключение
В последние десятилетия использовались различные подходы для улучшения определения видов циатостомина. У всех методов есть свои преимущества и ограничения (таблица), и ни один из них уже не является полностью удовлетворительным для получения ответов на исследовательские вопросы, и все они далеки от применимости в рутинной лабораторной диагностике.Всестороннее исследование различных аспектов улучшения различения отдельных видов циатостомина, таких как включение нескольких молекулярных маркеров и дополнительных протеомных профилей, может оказать большую помощь в будущем. Это должно включать морфологическую идентификацию вместе с описанием данных генотипа (молекулярного) и фенотипа (протеомного) в сочетании с принятой в настоящее время таксономической классификацией. В идеале следует использовать морфологические, молекулярные и протеомные данные одного и того же человека, чтобы воспользоваться всеми тремя подходами для определения полного спектра видов у Cyathostominae и определения их филогенетических взаимоотношений.
Таблица 1
Сравнение методов определения видов циатостомина.
| Метод идентификации | Жизненный этап | Полезность и ограничения | Ссылки | ||
|---|---|---|---|---|---|
| МОРФОЛОГИЧЕСКАЯ ИДЕНТИФИКАЦИЯ № | Lichtenfels, 1975, 2008; Двойнос и Харченко, 1994; Толливер, 2000; Lichtenfels et al., 2008; Харченко и др., 2009; Корнась и др., 2009; Santos et al., 2016 | ||||
| Личинки | L3 можно отнести к разным типам личинок, но не к отдельным видам | ||||
| Взрослые | Идентификационные ключи опубликованы, но идентификация видов затруднена для неопытных рабочих | ||||
| МОЛЕКУЛЯРНЫЕ МЕТОДЫ | |||||
| Маркер | Метод | ||||
| ITS-1 и 9077 9069 Все PC-1 и ITS-1 и ITS 9077 9069 последовательности 9069 ITS-1 и ITS 9077 Идентификация видов и филогенетический анализ, идентификация скрытых видов Иногда только небольшие различия между близкородственными видами Не применимо для смешанных образцов, необходимо выделение ДНК из отдельных образцов | Campbell et al., 1995; Чилтон и др., 1997; Hung et al., 1999a, 2000; Bu et al., 2013 | ||||
| SSCP-PCR | Все | Выделение 14 видов Strongylida (9 видов Cyathostomin), необходимо выделение ДНК из отдельных образцов | Gasser and Monti, 1997 | ||
| PCR-RFLP | Все | Отличие яиц Strongylinae, различие двух видов циатстомина ( C.ashworthi, C.nassatus ). Необходимо выделение ДНК из индивидуального образца, установленного для личинок | Campbell et al., 1995; Hung et al., 1997 | ||
| IGS | ПЦР-ELISA | Все | Возможен скрининг на 6 видов циатостомина в смешанных образцах. Установлено для яиц и личинок | Hodgkinson et al., 2003, 2005 | |
| RLB | Все | Дифференциация до 18 распространенных видов, менее трудоемкие и дорогостоящие, чем другие молекулярные методы, скрининг популяции стронгилов перед и после возможной антигельминтной обработки возможны смешанные образцы, но более жизнеспособные для отдельных глистов; возможен полуколичественный подход | Traversa et al., 2007; Ионита и др., 2010; Cwiklinski et al., 2012; Kooyman et al., 2016 | ||
| COI | ПЦР и секвенирование | Все | Исследование внутривидовой генетической изменчивости, идентификация скрытых видов, неприменимо для смешанных образцов, необходимо выделение ДНК из отдельных образцов | Hung et al. ., 1999а; Traversa et al., 2008 | |
| СЕРОЛОГИЧЕСКИЕ МЕТОДЫ | |||||
| ELISA на основе белков | Личинки | Возможно предварительное патентное обнаружение четырех распространенных видов циатостомина из сыворотки, дифференциация видов циатостомина невозможна. ., 2016 | |||
| МЕТОД ПРОТЕМИКИ | |||||
| Потенциально все | Метод разработан для бактерий, грибов, нескольких видов членистоногих; требуется только одно исследование нематод ( Trichinella, spp.), протоколы и база данных эталонных спектров | Karger et al., 2012; Yssouf et al., 2013, 2016; Mayer-Scholl et al., 2016; Singhal et al., 2016; | |||
Вклад авторов
CB провела эксперименты MALDI-TOF и обзоры литературы.CB и JK составили и отредактировали рукопись. ТК предоставила микрофотографии. ТК, Дж.М. и Г.С. участвовали в написании рукописи. CB, JK, JM и GS разработали общий план.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов. Рецензент MN заявил о своем прошлом соавторстве с одним из авторов GvS ответственному редактору, который обеспечил соответствие процесса стандартам справедливой и объективной рецензии.
Сноски
Финансирование. Работа получила финансовую поддержку от Deutsche Forschungsgemeinschaft (DFG GRK2046).
Ссылки
- Ахмад Ф., Гопал Дж., Ву Х. (2012). Быстрое и высокочувствительное обнаружение одиночных нематод с помощью прямой масс-спектрометрии MALDI. Таланта 93, 182–185. 10.1016 / j.talanta.2012.02.009 [PubMed] [CrossRef] [Google Scholar]
- Bevilaqua C. M. L., Rodrigues M., de L., Concordet D. (1993). Выявление инфекционных личинок некоторых обычных стронгилид нематод лошадей.Rev. Med. Вет. 144, 989–995. [Google Scholar]
- Blouin M. S. (2002). Молекулярный поиск криптических видов нематод: митохондриальная ДНК против внутреннего транскрибируемого спейсера. Int. J. Parasitol. 32, 527–531. 10.1016 / S0020-7519 (01) 00357-5 [PubMed] [CrossRef] [Google Scholar]
- Брианти Э., Джаннетто С., Траверса Д., Чиргвин С. Р., Шакья К., Клей Т. Р. (2009). In vitro Развитие личинок циатостомина от личинок третьей стадии до четвертой стадии: морфологическая характеристика, эффекты охлаждения и видоспецифические закономерности.Вет. Паразитол. 163, 348–356. 10.1016 / j.vetpar.2009.04.029 [PubMed] [CrossRef] [Google Scholar]
- Бу Й., Ню Х., Чжан Л. (2013). Филогенетический анализ рода Cylicocyclus (Nematoda: Strongylidae) на основе данных о последовательности ядерных рибосом. Acta Parasitol. 58, 167–173. 10.2478 / s11686-013-0124-z [PubMed] [CrossRef] [Google Scholar]
- Кэмпбелл А. Дж. Д., Гассер Р. Б., Чилтон Н. Б. (1995). Различия в последовательности ДНК рибосом у видов стронгилусов позволяют идентифицировать отдельные яйца.Int. J. Parasitol. 25, 359–365. 10.1016 / 0020-7519 (94) 00116-6 [PubMed] [CrossRef] [Google Scholar]
- Чепмен М. Р., Хатчинсон Г. В., Сенак М. Дж., Клей Т. Р. (1994). In vitro Культура конских стронгилид до четвертой личиночной стадии в бесклеточной среде. J. Parasitol. 80, 225–231. 10.2307 / 3283751 [PubMed] [CrossRef] [Google Scholar]
- Чилтон Н. Б. (2004). Использование ядерных рибосомных ДНК-маркеров для идентификации бурсатных нематод (отряд Strongylida) и для диагностики инфекций.Anim. Лечить. Res. Ред. 5, 173–187. 10.1079 / AHR200497 [PubMed] [CrossRef] [Google Scholar]
- Чилтон Н. Б., Гассер Р. Б., Беверидж И. (1997). Филогенетические отношения австралийских стронгилоидных нематод, выведенные из данных о последовательности рибосомной ДНК. Int. J. Parasitol. 27, 1481–1494. 10.1016 / S0020-7519 (97) 00134-3 [PubMed] [CrossRef] [Google Scholar]
- Кларк А. Э., Калета Э. Дж., Арора А., Волк Д. М. (2013). Матричная лазерная десорбционная ионизация-времяпролетная масс-спектрометрия: фундаментальный сдвиг в повседневной практике клинической микробиологии.Clin. Microbiol. Ред. 26, 547–603. 10.1128 / CMR.00072-12 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Corning S. (2009). Циатостомин лошади: обзор биологии, клинического значения и терапии. Паразит. Векторы 2 (Приложение 2): S1. 10.1186 / 1756-3305-2-s2-s1 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Цвиклински К., Койман Ф. Н. Дж., Ван Дорн Д. К., Мэтьюз Дж. Б., Ходжкинсон Дж. Э. (2012). Новое понимание вариации последовательности в области IGS 21 вида циатостомина и их значения для молекулярной идентификации.Паразитология 139, 1063–1073. 10.1017 / S0031182012000467 [PubMed] [CrossRef] [Google Scholar]
- Даудалл С. М. Дж., Мэтьюз Дж. Б., Мэйр Т., Мерфи Д., Лав С., Праудмен К. Дж. (2002). Антиген-специфические ответы IgG (T) при естественной и экспериментальной инфекции cyathostominae у лошадей. Вет. Паразитол. 106, 225–242. 10.1016 / S0304-4017 (02) 00085-7 [PubMed] [CrossRef] [Google Scholar]
- Даудалл С. М. Дж., Праудмен К. Дж., Клей Т. Р., Майр Т., Мэтьюз Дж. Б. (2004). Характеристика ответов сывороточных антител IgG (T) на два комплекса личиночных антигенов у лошадей, естественно или экспериментально инфицированных циатостоминами.Int. J. Parasitol. 34, 101–108. 10.1016 / j.ijpara.2003.09.008 [PubMed] [CrossRef] [Google Scholar]
- Даудалл С. М. Дж., Праудмен К. Дж., Лав С., Клей Т. Р., Мэтьюз Дж. Б. (2003). Очистка и анализ специфичности двух предполагаемых диагностических антигенов для личиночной инфекции циатостомина у лошадей. Res. Вет. Sci. 75, 223–229. 10.1016 / S0034-5288 (03) 00116-4 [PubMed] [CrossRef] [Google Scholar]
- Чернянска Д., Паолетти Б., Кралова-Громадова И., Иорио Р., Чудекова П., Милилло П., и другие. . (2009). Применение метода гибридизации с обратной линией блоттинга для видоспецифической идентификации циатостоминов (Nematoda, Strongylida) от лошадей, получавших бензимидазол, в Словацкой Республике. Вет. Паразитол. 160, 171–174. 10.1016 / j.vetpar.2008.10.078 [PubMed] [CrossRef] [Google Scholar]
- Драдж Дж. Х., Лайонс Э. Т. (1977). Методы оценки противопаразитарных препаратов лошади. Являюсь. J. Vet. Res. 38, 1581–1586. [PubMed] [Google Scholar]
- Драдж Дж. Х., Сзанто Дж., Вайант З. Н., Элам Г. (1963). Критические испытания тиабендазола как глистогонного средства у лошадей. Являюсь. J. Vet. Res. 24, 1217–1222. [PubMed] [Google Scholar]
- Двойнос Г. М., Харченко В. О. (1994). Стронгилиды диких и домашних лошадей. Киев: Наукова думка. [Google Scholar]
- Старейшина Дж. Ф. Дж., Тернер Б. Дж. (1995). Согласованная эволюция повторяющихся последовательностей ДНК у эукариот. Q. Rev. Biol. 70, 297–320. 10.1086 / 419073 [PubMed] [CrossRef] [Google Scholar]
- Гассер Р.Б., Монти Дж. Р. (1997). Идентификация паразитарных нематод с помощью ПЦР-SSCP рДНК ITS-2. Мол. Клетка. Зонды 11, 201–209. 10.1006 / mcpr.1997.0106 [PubMed] [CrossRef] [Google Scholar]
- Гассер Р. Б., Ньютон С. Э. (2000). Геномные и генетические исследования бурсатных нематод: значение, значение и перспективы. Int. J. Parasitol. 30, 509–534. 10.1016 / S0020-7519 (00) 00021-7 [PubMed] [CrossRef] [Google Scholar]
- Херд Р. П. (1990). Изменяющийся мир червей: рост циатостомов и упадок стронгилусов обыкновенных.Компенд. Продолжить. Educ. Практик. Вет. 12, 732–736. [Google Scholar]
- Ходжкинсон Дж. Э., Фриман К. Л., Лихтенфельс Дж. Р., Палфреман С., Лав С., Мэтьюз Дж. Б. (2005). Идентификация яиц стронгила от лошадей, получавших антигельминтные средства, с использованием ПЦР-ИФА на основе межгенных последовательностей ДНК. Паразитол. Res. 95, 287–292. 10.1007 / s00436-004-1289-z [PubMed] [CrossRef] [Google Scholar]
- Hodgkinson J. E., Lichtenfels J. R., Mair T. S., Cripps P., Freeman K. L., Ramsey Y. H., et al. . (2003).ПЦР-ИФА для идентификации личинок циатостомина четвертой стадии из клинических случаев личиночного циатостоминоза. Int. J. Parasitol. 33, 1427–1435. 10.1016 / S0020-7519 (03) 00140-1 [PubMed] [CrossRef] [Google Scholar]
- Хоппенгейт А., Муругайян Дж., Бауэр Б., Штеубер С., Клаузен П. Х., Розлер У. (2013). Идентификация цеце ( Glossina spp.) С использованием матричной лазерной десорбции / ионизации, времяпролетной масс-спектрометрии. PLoS Negl. Троп. Дис. 7: e2305. 10.1371 / журнал.pntd.0002305 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Хунг Г. К., Чилтон Н. Б., Беверидж И., Гассер Р. Б. (2000). Молекулярная систематическая основа для конских стронгилей, основанная на данных о последовательности рибосомной ДНК. Int. J. Parasitol. 30, 95–103. 10.1016 / S0020-7519 (99) 00166-6 [PubMed] [CrossRef] [Google Scholar]
- Хунг Г. К., Чилтон Н. Б., Беверидж И., Макдоннелл А., Лихтенфельс Дж. Р., Гассер Р. Б. (1997). Молекулярное разграничение Cylicocyclus nassatus и C.ashworthi (Нематоды: Strongylidae). Int. J. Parasitol. 27, 601–605. 10.1016 / S0020-7519 (96) 00192-0 [PubMed] [CrossRef] [Google Scholar]
- Хунг Г. К., Чилтон Н. Б., Беверидж И., Чжу X. К., Лихтенфельс Дж. Р., Гассер Р. Б. (1999a). Молекулярные доказательства криптических видов в пределах Cylicostephanus minutus (Nematoda: Strongylidae). Int. J. Parasitol. 29, 285–291. 10.1016 / S0020-7519 (98) 00203-3 [PubMed] [CrossRef] [Google Scholar]
- Хунг Г. К., Гассер Р. Б., Беверидж И., Чилтон Н. Б. (1999b). Видоспецифическая амплификация с помощью ПЦР рибосомальной ДНК некоторых конских стронгилей. Паразитол. 119 (Pt 1), 69–80. [PubMed] [Google Scholar]
- Ионита М., Хоу Д. К., Лайонс Э. Т., Толливер С. К., Каплан Р. М., Митреа И. Л. и др. . (2010). Использование метода блоттинга с обратной линией для обследования небольших популяций стронгилидов (Strongylida: Cyathostominae) у лошадей до и после лечения ивермектином. Вет. Паразитол. 168, 332–337. 10.1016 / j.vetpar.2009.11.021 [PubMed] [CrossRef] [Google Scholar]
- Каплан Р.М. (2002). Противогельминтная устойчивость нематод лошадей. Вет. Res. 33, 491–507. 10.1051 / vetres: 2002035 [PubMed] [CrossRef] [Google Scholar]
- Каргер А., Кампен Х., Беттин Б., Даутель Х., Циллер М., Хоффманн Б. и др. . (2012). Определение видов и характеристика стадий развития клещей с помощью лазерной десорбционно-ионизационной масс-спектрометрии на всем животном. Клещи Tick Borne Dis. 3, 78–89. 10.1016 / j.ttbdis.2011.11.002 [PubMed] [CrossRef] [Google Scholar]
- Kaye J.Н., Лав С., Лихтенфельс Дж. Р., Маккинд Дж. Б. (1998). Сравнительный анализ последовательности межгенного спейсерного участка циатостомов. Int. J. Parasitol. 28, 831–836. 10.1016 / S0020-7519 (98) 00031-9 [PubMed] [CrossRef] [Google Scholar]
- Харченко В., Кузьмина Т., Трауфорд А., Гетачью М., Фесеха Г. (2009). Морфология и диагностика некоторых личинок циатостоминов четвертой стадии (Nematoda: Strongyloidea) ослов Equus asinus L. из Эфиопии. Syst. Паразитол. 72, 1–13.10.1007 / s11230-008-9152-8 [PubMed] [CrossRef] [Google Scholar]
- Койман Ф. Н. Дж., Ван Дорн Д. К. К., Геурден Т., Вагенаар Дж. А. (2016). Полуколичественная дифференциация культур личинок циатостомина методом обратного блоттинга. Вет. Паразитол. 216, 59–65. 10.1016 / j.vetpar.2015.12.009 [PubMed] [CrossRef] [Google Scholar]
- Корнась С., Гавор Дж., Кабаре Дж., Моленда К., Скальска М., Новосад Б. (2009). Морфометрическая идентификация инфекционных личинок циатостома лошадиных (Nematoda: Cyathostominae).Вет. Паразитол. 162, 290–294. 10.1016 / j.vetpar.2009.03.018 [PubMed] [CrossRef] [Google Scholar]
- Кузьмина Т.А., Харченко В.А., Старовир А.И., Двойнос Г.М. (2005). Анализ сообщества стронгилидных нематод (Nematoda: Strongylidae) после дегельминтизации маточных лошадей в Украине. Вет. Паразитол. 131, 283–290. 10.1016 / j.vetpar.2005.05.010 [PubMed] [CrossRef] [Google Scholar]
- Кузьмина Т.А., Харченко В.О. (2008). Антигельминтная резистентность циатостоминов племенных лошадей в Украине и влияние антигельминтных обработок на структуру сообщества стронгилидов.Вет. Паразитол. 154, 277–288. 10.1016 / j.vetpar.2008.03.024 [PubMed] [CrossRef] [Google Scholar]
- Лихтенфельс Дж. Р. (1975). Гельминты домашних непарнокопытных. Иллюстрированные определения родов и видов с акцентом на североамериканские формы. Proc. Гельминтол. Soc. Стирать. 42, 1–83. [Google Scholar]
- Лихтенфельс Дж. Р. (2008). Предисловие. Вет. Паразитол. 156, 1–3. 10.1016 / j.vetpar.2008.06.026 [PubMed] [CrossRef] [Google Scholar]
- Лихтенфельс Дж. Р., Гиббонс Л. М., Кречек Р. С. (2002).Рекомендуемая терминология и достижения в систематике Cyathostominea (Nematoda: Strongyloidea) лошадей. Вет. Паразитол. 107, 337–342. 10.1016 / S0304-4017 (02) 00167-X [PubMed] [CrossRef] [Google Scholar]
- Лихтенфельс Дж. Р., Харченко В. А., Двойнос Г. М. (2008). Иллюстрированные идентификационные ключи к стронгилидам-паразитам (Strongylidae: Nematoda) лошадей, зебр и ослов (Equidae). Вет. Паразитол. 156, 4–161. 10.1016 / j.vetpar.2008.04.026 [PubMed] [CrossRef] [Google Scholar]
- Lichtenfels J.Р., Харченко В. А., Кречек Р. С., Гиббонс Л. М. (1998). Аннотированный контрольный список по родам и видам из 93 названий уровня видов для 51 признанного вида мелких стронгилов (Nematoda: Strongyloidea: Cyathostominea) лошадей, ослов и зебр всего мира. Вет. Паразитол. 79, 65–79. 10.1016 / S0304-4017 (98) 00149-6 [PubMed] [CrossRef] [Google Scholar]
- Лонг Э. О., Давид И. Б. (1980). Повторяющиеся гены у эукариот. Анну. Rev. Biochem. 49, 727–764. 10.1146 / annurev.bi.49.070180.003455 [PubMed] [CrossRef] [Google Scholar]
- Лоос А.(1900). Notizen zur Helminthologie Egypt. III. Die Sclerostomen der Pferde und Esel в Египте. Cent. Бактериол. 1, 150–160–192. [Google Scholar]
- Лав С., Мерфи Д., Меллор Д. (1999). Патогенность циатостомной инфекции. Вет. Паразитол. 85, 113–122. 10.1016 / S0304-4017 (99) 00092-8 [PubMed] [CrossRef] [Google Scholar]
- Лайонс Э. Т., Толливер С. С., Коллинз С. С. (2007). Исследование (1991–2001 гг.) Устойчивых к лекарствам малых стронгилей популяции B в критических испытаниях на лошадях в Кентукки по окончании 40-летнего исследования.Паразитол. Res. 101, 689–701. 10.1007 / s00436-007-0535-6 [PubMed] [CrossRef] [Google Scholar]
- Lyons E. T., Tolliver S. C., Drudge J. (1999). Историческая перспектива циатостомов: распространенность, программы лечения и контроля. Вет. Паразитол. 85, 97–112. 10.1016 / S0304-4017 (99) 00091-6 [PubMed] [CrossRef] [Google Scholar]
- Лайонс Э. Т., Толливер С. С., Кузьмина Т. А., Коллинз С. С. (2010). Критические тесты, оценивающие эффективность моксидектина против небольших стронгилей у лошадей из стада, для которых в полевых испытаниях в Центральном Кентукки была обнаружена пониженная активность.Паразитол. Res. 107, 1495–1498. 10.1007 / s00436-010-2025-5 [PubMed] [CrossRef] [Google Scholar]
- Мэтьюз Дж. Б. (2014). Устойчивость к глистогонам у нематод лошадей. Int. J. Parasitol. Наркотики Лекарственное сопротивление. 4, 310–315. 10.1016 / j.ijpddr.2014.10.003 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Mayer-Scholl A., Murugaiyan J., Neumann J., Bahn P., Reckinger S., Nöckler K . (2016). Быстрая идентификация возбудителя пищевого происхождения Trichinella spp. с помощью матричной лазерной десорбционно-ионизационной масс-спектрометрии.PLoS ONE 11: e0152062. 10.1371 / journal.pone.0152062 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Макдоннелл А., Лав С., Тейт А., Лихтенфельс Дж. Р., Мэтьюз Дж. Б. (2000). Филогенетический анализ частичной митохондриальной субъединицы c цитохромоксидазы I и последовательностей больших рибосомных РНК и ядерных внутренних транскрибированных последовательностей спейсера I из видов Cyathostominae и Strongylinae (Nematoda, отряд Strongylida), паразитов лошади. Паразитология 121, 649–659. 10.1017 / s003118200000696x [PubMed] [CrossRef] [Google Scholar]
- McWilliam H.Э. Г., Нисбет А. Дж., Даудалл С. М. Дж., Ходжкинсон Дж. Э., Мэтьюз Дж. Б. (2010). Идентификация и характеристика иммунодиагностического маркера личинок на стадии развития циатостомина. Int. J. Parasitol. 40, 265–275. 10.1016 / j.ijpara.2009.08.004 [PubMed] [CrossRef] [Google Scholar]
- Mitchell M. C., Tzelos T., Handel I., McWilliam H. E. G., Hodgkinson J. E., Nisbet A. J., et al. . (2016). Разработка ИФА на основе рекомбинантных белков для диагностики личиночной инфекции циатостомином.Паразитология 143, 1055–1066. 10.1017 / S0031182016000627 [PubMed] [CrossRef] [Google Scholar]
- Молин Р. (1861 г.). Il sottordine degli acrofalli ordinato scientificamente secondo i risultamenti delle indagini anatomiche ed embrigeniche. Mem. R. Ist. Veneto Sc. Lett Arti 9, 427–633. [Google Scholar]
- Мерфи Д., Лав С. (1997). Патогенные эффекты экспериментальных циатостомных инфекций у пони. Вет. Паразитол. 70, 99–110. 10.1016 / S0304-4017 (96) 01153-3 [PubMed] [CrossRef] [Google Scholar]
- Nielsen M.К., Райнемейер К. Р., Донеккер Дж. М., Литвик Д. М., Маркиондо А. А., Каплан Р. М. (2014). Устойчивость к глистогонам у паразитов лошадей — Текущие данные и пробелы в знаниях. Вет. Паразитол. 204, 55–63. 10.1016 / j.vetpar.2013.11.030 [PubMed] [CrossRef] [Google Scholar]
- Остерман Линд Э., Эйскер М., Нильссон О., Уггла А., Хёглунд Дж. (2003). Изгнание мелких стронгиловых нематод (cyathostomin spp) после дегельминтизации лошадей на конезаводе в Швеции. Вет. Паразитол. 115, 289–299. 10.1016 / S0304-4017 (03) 00200-0 [PubMed] [CrossRef] [Google Scholar]
- Perera M.Р., Ванстон В. А., Джонс М. Г. (2005). Новый подход к идентификации нематод, паразитирующих в растениях, с использованием времяпролетной масс-спектрометрии с лазерной десорбцией и ионизацией с использованием матрицы. Rapid Commun. Масс-спектрометрия. 19, 1454–1460. 10.1002 / rcm.1943 [PubMed] [CrossRef] [Google Scholar]
- Перера М., Тейлор С., Джонс М., Ванстон В. (2009). Белковые биомаркеры для различения овсяной и люцерновой рас стеблевой нематоды Ditylenchus dipsaci, имеющих карантинное значение для Западной Австралии. Нематология 11, 555–563.10.1163 / 138855409X12465362560557 [CrossRef] [Google Scholar]
- Сантос Д. В., Диас де Кастро Л. Л., Гиз Э. Г., Моленто М. Б. (2016). Морфометрическое исследование инфекционных личинок циатостоминов лошадей и их распространение. J. Equine Vet. Sci. 44, 49–53. 10.1016 / j.jevs.2016.02.237 [CrossRef] [Google Scholar]
- Сингхал Н., Кумар М., Вирди Дж. С. (2016). MALDI-TOF MS в клинической паразитологии: приложения, ограничения и перспективы. Паразитология 143, 1491–1500. 10.1017 / S0031182016001189 [PubMed] [CrossRef] [Google Scholar]
- Smyth J.Д. (1990). Выращивание паразитарных гельминтов in vitro. Бока-Ратон, Флорида: CRC Press Inc. [Google Scholar]
- Толливер С.С. (2000). Практический метод идентификации североамериканских Cyathostomes (Small Strongyles) у лошадей в Кентукки. Лексингтон: Университет Кентукки, факультет ветеринарии. [Google Scholar]
- Траверса Д., Иорио Р., Клей Т. Р., Харченко В. А., Гавор Дж., Отранто Д. и др. . (2007). Новый метод одновременной видоспецифической идентификации конских стронгилов (нематоды, стронгилиды) с помощью блот-гибридизации с обратной линией.J. Clin. Microbiol. 45, 2937–2942. 10.1128 / JCM.00714-07 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Траверса Д., Кузьмина Т., Харченко В. А., Иорио Р., Клей Т. Р., Отранто Д. (2008). Гаплотипическая изменчивость внутри митохондриального гена, кодирующего цитохром с оксидазу 1 (cox1) из Cylicocyclus nassatus (Nematoda, Strongylida): свидетельство принадлежности паразитарных популяций к хозяевам домашних и диких непарнокопытных. Вет. Паразитол. 156, 241–247. 10.1016 / j.vetpar.2008.05.031 [PubMed] [CrossRef] [Google Scholar]
- Traversa D., Milillo P., Barnes H., von Samson-Himmelstjerna G., Schurmann S., Demeler J., et al. . (2010). Распространение и видоспецифическая встречаемость циатостоминов (Nematoda, Strongylida) у естественно инфицированных лошадей из Италии, Великобритании и Германии. Вет. Паразитол. 168, 84–92. 10.1016 / j.vetpar.2009.10.006 [PubMed] [CrossRef] [Google Scholar]
- Фон Самсон-Химмельстьерна Г. (2012). Устойчивость к глистогонам у паразитов лошадей — выявление, потенциальная клиническая значимость и значение для борьбы.Вет. Паразитол. 185, 2–8. 10.1016 / j.vetpar.2011.10.010 [PubMed] [CrossRef] [Google Scholar]
- Визер А., Шнайдер Л., Юнг Дж., Шуберт С. (2012). MALDI-TOF MS в микробиологической диагностике-идентификации микроорганизмов и за ее пределами (мини-обзор). Прил. Microbiol. Biotechnol. 93, 965–974. 10.1007 / s00253-011-3783-4 [PubMed] [CrossRef] [Google Scholar]
- Исуф А., Альмерас Л., Рауль Д., Парола П. (2016). Новые инструменты для идентификации членистоногих-переносчиков. Future Microbiol.11, 549–566. 10.2217 / fmb.16.5 [PubMed] [CrossRef] [Google Scholar]
- Исуф А., Соколовски К., Флаудропс К., Ндиат М. О., Сугуфара С., Дехек Дж. С. и др. . (2013). Матричная лазерная десорбционная ионизация — времяпролетная масс-спектрометрия: новый инструмент для быстрой идентификации комаров-переносчиков. PLoS ONE 8: e72380. 10.1371 / journal.pone.0072380 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Что такое нематоды? Эти крошечные черви могут помочь или навредить вашему саду
Д.Кухарский + К. Кухарская / Shutterstock
Хотя большинство из тысяч видов нематод на Земле не являются вредными, некоторые из них вызывают болезни у людей и других животных или атакуют живые растения и питаются ими. К счастью, есть способы удержать этих надоедливых вредителей от разрушения почвы в саду.
Несколько паразитических видов этих полупрозрачных несегментированных червей размером около 1/50 дюйма в длину и вызывают корневые узлы или галлы, поврежденные кончики корней, чрезмерное ветвление корней, галлы на листьях, поражения или отмирание ткани, а также скрученные деформированные листья.Наиболее часто поражаются корни растений, включая помидоры черри, картофель, перец, салат, кукурузу и морковь. Растения, страдающие травмой листовой и стеблевой системы, включают хризантемы, лук, рожь и люцерну.
Что такое нематоды?
Нематоды, которых часто называют круглыми червями, не имеют близкого родства с настоящими червями. Это многоклеточные насекомые с гладким несегментированным телом. Виды нематод, которые питаются растениями, настолько крошечные, что вам понадобится микроскоп, чтобы их увидеть. Взрослые особи часто выглядят длинными и стройными, хотя некоторые виды кажутся грушевидными.Эти паразиты растений , а не те же круглые черви, что и филяриальные нематоды, которые заражают человеческий организм, распространяют болезни и наносят ущерб иммунной системе.
Некоторые нематоды питаются внешними поверхностями растений, в то время как другие зарываются в ткани. Нематоды, обитающие в почве, являются наиболее распространенными виновниками, но некоторые виды могут повреждать корни, стебли, листву и цветы растений.
Независимо от того, где они кормятся, эти крошечные черви могут серьезно повредить посевы своим острым ртом, прокалывая стенки клеток.Настоящее повреждение происходит, когда нематода вводит слюну в клетку изо рта, а затем высасывает ее содержимое. Растение реагирует на паразитических червей опуханием, искажением роста и мертвыми участками. Нематоды также могут переносить вирусы, а бактериальные заболевания вводят их в растения. Раны, которые они наносят, также являются легким местом проникновения бактерий и грибков.
Полезные нематоды, обогащающие почву, могут питаться разлагающимся материалом, насекомыми или другими нематодами.
Как выглядят нематоды
В отличие от большинства других болезнетворных организмов нематоды, паразитирующие на растениях, редко вызывают какие-либо характерные симптомы.Большинство симптомов, которые действительно появляются, расплывчаты и часто напоминают симптомы, вызванные другими факторами, такими как вирусы, недостаток питательных веществ или загрязнение воздуха. Нематоды, питающиеся над землей, могут вызывать скрученные и деформированные листья, стебли и цветы.
Корневые узелки, пораженные нематодами.Getty Images
Если нематоды питаются корнями, растение может выглядеть пожелтевшим, увядшим или низкорослым, а инфицированные пищевые культуры обычно не дают урожая.Если вы подозреваете, что червь повредил корни, осторожно поднимите одно из зараженных растений и промойте корни для облегчения осмотра. Если нематоды вызывают повреждение, вы можете увидеть небольшие галлы или поражения, поврежденные кончики корней, корневую гниль или чрезмерное ветвление корня.
Как они распространяются
Питаются ли они над землей или под землей, большинство нематод проводят в почве по крайней мере часть своего жизненного цикла. Хотя они не могут двигаться очень далеко самостоятельно, они могут свободно плавать в воде и двигаться быстрее во влажной почве, поэтому рекомендуется поддерживать воду в хорошо дренированном состоянии.Они также распространяются через все, что может переносить частицы зараженной почвы, включая инструменты, обувь, животных и зараженные растения.
А как насчет полезных нематод?
Полезные нематоды могут иметь длину от 1/25 до нескольких дюймов и иметь тонкие, полупрозрачные, несегментированные тела. Их роли в саду различаются. Некоторые из них являются обитателями почвы, которые разрушают органические вещества, особенно в компостных кучах. Вы можете легко обнаружить эти разложения длиной 1/4 дюйма.
Эти типы фактически борются с различными видами вредителей, включая долгоносиков, яснокрылых, совок, дерновых паутинных червей, клопов и белых личинок.Нематоды нападают и убивают этих насекомых, вводя смертоносные бактерии или проникая в хозяина, паразитируя, а затем питаясь им.
При покупке и применении их в своем саду очень важно выбрать правильный вид, потому что разные виды нематод эффективны против разных вредителей. Кроме того, нематодам необходимы влажные, влажные условия и достаточно теплая почва, чтобы хорошо выполнять свою работу. Поливайте все участки нанесения до и после распространения нематод и тщательно следуйте инструкциям по нанесению.
Этот контент создается и поддерживается третьей стороной и импортируется на эту страницу, чтобы помочь пользователям указать свои адреса электронной почты. Вы можете найти больше информации об этом и подобном контенте на сайте piano.io.
Знакомство с нематодами
Знакомство с нематодамиВведение в нематоды
Ред. 24.08.2021
Нематоды беспозвоночные круглые черви, которые населяют морская, пресноводная и наземная среда.Они входят в тип Nematoda (или Nemata), который включает паразитов растений и животных, в том числе люди, а также виды, которые питаются бактерии, грибы, водоросли и другие нематоды. Четыре из каждых пяти многоклеточных животных на планете — нематоды. (Платт, 1994). Кобб (1914) подсчитал, что если нематоды, обитающие в один акр земли недалеко от Сан-Антонио, штат Техас, США, должен был пройти в шествие в Вашингтон Д.C., примерно в 2000 милях отсюда, первый нематода достигнет Вашингтона до того, как задняя часть процессии покинет Сан Антонио!
Вокал: Pointless Сестры |
Большая часть чего-либо нематоды микроскопические, в среднем менее миллиметра в длину, но некоторые паразиты животных довольно большие и легко видны невооруженным глазом.Паразиты животных и растений имеют непосредственное важность для сельского хозяйства, окружающей среды и здоровья человека; однако большинство нематод в окружающей среде не являются паразитами. Нематоды, питающиеся другими организмами, являются важными участниками круговорот минералов и питательных веществ в экосистеме, что имеет основополагающее значение для другая биологическая активность. Некоторые из этих нематод могут играют важную роль в разложении, в том числе биоразложение токсичных соединений.Фактически заболеваемость некоторыми видами нематод иногда используется как показатель качества окружающей среды. Насекомые-паразиты нематоды могут играть важную роль в регулировании популяций насекомых и являются используется для биологической борьбы с насекомыми-вредителями.
Биология развития одного вида нематод, Caenorhabditis elegans , является лучше охарактеризован, чем любой другой многоклеточный организм. C. elegans изучается как модельная система в молекулярной биологии и биологии развития, а также дает представление о многих других области биологии и медицины.
Борьба с нематодами, паразитирующими на растениях, имеет фундаментальное значение для развития сельскохозяйственного производства в Соединенных Штатах и во всем мире. Однако использование некоторых пестицидов, таких как 1,2-дибром-3-хлорпропан (DBCP) для борьбы с нематодами, привело к загрязнению почвы и грунтовых вод в Калифорнии.Текущее исследование направлено на поиск интегрированных и устойчивых подходов к борьбе с нематодой
.
популяций посредством генетических манипуляций с растениями-хозяевами, проектирования систем земледелия, разработки подавляющих химических веществ ботанического происхождения и биологического контроля.
В настоящее время предпринимаются серьезные усилия по переходу от борьбы с нематодами на основе нематод к альтернативным методам. Около 15 миллионов фунтов 1,3-Дихлорпропен ежегодно используется примерно на 200 000 акров в Калифорнии.Альтернативы этому подходу имеют решающее значение, особенно после того, как 13 апреля 1990 года Департамент продовольствия и сельского хозяйства Калифорнии (CDFA) приостановил использование 1,3-дихлорпропена. Поскольку альтернативные подходы в большей степени ориентированы на конкретные цели и системы, необходимо будет установить приоритеты для исследований и разработок в прикладной нематологии. В то же время необходимо развивать и поддерживать прочные связи с более основными областями биологии нематод, чтобы способствовать развитию новых технологий.
Паразиты животных
Из девятнадцати отрядов в типе Nematoda семь содержат нематод, которые являются паразитами или партнерами беспозвоночных, а шесть включают виды, являющиеся паразитами позвоночных животных. Сообщается, что нематоды являются паразитами и партнерами многих беспозвоночных животных, особенно Annelida, Mollusca и Arthropoda.В некоторых случаях беспозвоночное действует как промежуточный хозяин в жизненном цикле, который включает паразитизм позвоночного. В других случаях беспозвоночное, обычно насекомое, действует как переносчик между позвоночными-хозяевами, или нематода пассивно переносится насекомым. Несколько интересных растений —
паразитические нематоды попадают в эту последнюю группу и, что важно, они тесно связаны с видами нематод, которые являются паразитами насекомых.Значительные усилия были приложены к использованию нематод-паразитов насекомых в качестве агентов биологической борьбы, например, с комарами и мошками (Maggenti, 1981).
Некоторые из нематод, ассоциированных с насекомыми, важны, потому что они переносят бактерии, убивающие насекомых. Нематода вторгается в насекомое (или поедается им), и бактерии попадают в гемолимфу насекомого. Когда насекомое мертвое или близкое к смерти, происходит рост и последующее развитие нематод, поскольку они используют необходимые стероиды, поставляемые насекомым (Maggenti, 1981).Эти нематоды также широко используются для биологической борьбы с насекомыми и особенно эффективны против тех насекомых, которые переносят по крайней мере одну жизнь
этап в почве.
Некоторые
По оценкам, 5000 видов нематод
быть паразитами позвоночных животных и человека. Эти
виды часто характеризуются большей группой
глисты-паразиты как гельминты.Нематоды-паразиты
домашние позвоночные животные содержатся
стратегии, которые включают контроль
вторичные хозяева или векторы и
использование химических глистогонных средств. Гельминт
инфекции диких животных, конечно, не контролируются,
кроме истощения инфицированных
частные лица. Как человеческая демография
модели меняются в Калифорнии и во всем мире,
граница между ареалами и местообитаниями
дикие и домашние животные меняются и пересекаются.
Следовательно, характер воздействия на домашних животных
гельминтозы тоже меняются, и появляются новые
ассоциации продолжают поступать; для
Например, заболеваемость сердечным червем ( Dirofilaria
immitis ) инфекция у собак в настоящее время увеличивается.
Калифорния.
В целом, паразиты нематоды дикой природы Калифорнии были изучены только описательно.Предстоит изучить много интересного биологии. Исследования паразитов-диплотриенид из воздушных мешков калифорнийских ласточек показывают, что птицы несут значительную биомассу паразитов-нематод во время своих ежегодных миграций. Исследования поднимают интересные экологические вопросы, касающиеся эффективности полета и энергетики, а также предоставляют модели для рассмотрения распространения паразитов.
Пресноводные и морские рыбы подвержены нематодным инфекциям.Влияние инфекций на здоровье и долголетие рыб в природе обычно неизвестно. Часто нематоды обнаруживаются в тканях рыб, приобретаемых потребителями. Нематоды обычно погибают во время приготовления пищи, но, безусловно, передача паразитов живых рыб людям может происходить во время употребления сашими и других продуктов из сырой рыбы. Как правило, эти нематоды не вызывают постоянную инфекцию у людей, но могут вызывать кишечные расстройства в
пытаюсь это сделать.
Паразиты человека
Есть и другие хорошо известные примеры передачи нематод человеку. В большинстве случаев частота инфицирования относительно низка из-за регулирующего контроля пищевых продуктов, просвещения населения и приготовления пищи. Пример — трихинеллез, вызванный нематодой. Trichinella spiralis .Люди заражаются Trichinella , употребляя в пищу сырую или недоваренную свинину.
Человеческие нематоды-паразиты вызывают множество заболеваний и симптомов, от недостатка энергии и энергии до слепоты и пороков развития. Острицы, анкилостомы и круглые черви — чрезвычайно распространенные кишечные гельминтозы человека; во всем мире круглые черви, вероятно, являются наиболее распространенными, но в США.С., преобладают острицы. Передача остриц обычно происходит при приеме внутрь
.
материал, загрязненный фекалиями, и инфекция часто встречается у детей.
Другие гельминтозы переносятся насекомыми, такими как комары, как нитчатые черви, или же филярии могут проникать непосредственно через кожу из воды или почвы. Филяриозные черви вызывают такие заболевания, как речная слепота ( Onchocerca volvulus ) и слоновость, которые представляют собой серьезную проблему для здоровья в некоторых странах третьего мира.В Соединенных Штатах большинство гельминтозных инфекций человека контролируется программами общественного здравоохранения, общественным образованием,
борьба с переносчиками болезней, промежуточная борьба с хозяевами и противоглистные препараты. Однако изменение демографических моделей, включая иммиграцию новых жителей Калифорнии из стран третьего мира, привело к появлению в штате незнакомых гельминтозов. Часто сотрудники отделений нематологии консультируются с сотрудниками общественного здравоохранения для выявления незнакомых нематод.
Нематоды-паразиты в лесном хозяйстве
В Калифорнии лесное хозяйство играет важную роль в производстве пиломатериалов, пиломатериалов и отдыха. Однако оценка воздействия нематод на урожай и качество пиломатериалов в лесном хозяйстве является особенно сложной задачей, поскольку цикл лесозаготовок может достигать 75 лет, а география земель и состав почвы чрезвычайно разнообразны.Воздействие нематод может происходить через паразитирование растений; грибковое питание нематодами, приводящее к уничтожению микоризы, необходимой для роста лесов; и наземные паразитические нематоды-паразиты, переносимые насекомыми, например нематода сосновая.
Предварительные исследования показали, что существует совершенно новый набор нематод-вредителей, обитающих в лесах Калифорнии, в дополнение к известным сельскохозяйственным вредителям, которые питаются местными лесными видами. Важно, чтобы мы начали накапливать базовую информацию о нематодах-вредителях лесов Калифорнии, особенно потому, что таких программ не существует в западной части Соединенных Штатов.
Недавние планы по отгрузке необработанных пиломатериалов из Сибири для переработки в северной Калифорнии могут развеять опасения общественности по поводу вырубки лесов в США; однако анализ сибирских бревен выявил высокий потенциал интродукции новых вредителей. В число вредителей, обнаруженных в древесине, входят нематода Bursaphelenchus mucronatus и связанные с ней насекомые-переносчики. B. mucronatus не зарегистрирован в США и является близким родственником сосновой нематоды, опустошившей леса в Японии. Хотя сосновая нематода уже встречается в США, ее обнаружение в древесной щепе, экспортируемой в Скандинавию, привело к запрету на эти продукты. Безусловно, существуют подходы к снижению вероятности появления новых вредных организмов, включая окорку и фумигацию бревен перед отправкой.
Нематоды на пастбищах
Что касается пастбищных угодий, необходимо рассмотреть ряд нематод, отличный от тех, которые влияют на сельское и лесное хозяйство.К числу проблем, связанных с нематодами, относятся не только корневые и листовые паразиты, но и болезни, возникающие в результате ассоциаций нематод и микроорганизмов. Последний аспект, возможно, лучше всего иллюстрируется ассоциацией нематод и бактерий, при которой травяной корм становится токсичным для домашнего скота; Эта ситуация представляет собой серьезную проблему в Австралии, где большое количество овец, а в некоторых районах и полностью оставленные без присмотра службы
стада убиты. Эта нематода ( Anguina agrostis ) и связанная с ней бактерия ( Clavibacter sp.) Также существуют в северной Калифорнии и южном Орегоне. Поскольку животноводство и молочная промышленность составляют основной компонент сельскохозяйственного производства в Калифорнии, а пастбищные угодья и леса составляют примерно две трети территории Калифорнии, важность проблем нематод на пастбищных угодьях и необходимость дополнительных исследований в этой области становится очевидной. Чисто.
Методы прямого контроля, используемые для борьбы с нематодами в традиционном сельском хозяйстве, скорее всего, непрактичны в условиях ареала обитания.Решение проблем пастбищ и лесов зависит от альтернативных технологий, которые, в свою очередь, зависят от обширной базовой информации, включающей характеристики нематод, характеристики растений, а также экологические и почвенные факторы.
Нематоды водных систем
Нематоды по своей природе являются водными организмами.По оценкам, около 50% видов нематод обитают в морской среде, хотя многие из них еще предстоит описать и охарактеризовать. Остальные виды обитают в почве и пресной воде. В почве их потребности в воде удовлетворяются за счет заселения водных пленок вокруг частиц почвы. Паразитические нематоды являются биологически активными, когда они купаются в пленках влаги, поступающих с водой в ткани или жидкости организма хозяина.
Зуллини и Семпруччи сравнили характеристика почвенных и пресноводных нематод. Они отметили, что водные (= открытая вода) и полуводные виды в среднем длиннее и стройнее, чем почвенные виды, у них более длинный хвост, большая масса тела, гладкая кутикула и более крупные амфиды. Обычно, но не всегда нематоды, живущие в пресноводных отложениях и на них, характеризуются по:
я) Длинный головной и соматические щетинки . Щетинки по сути являются полезными сенсорными устройствами.Ограничительная толщина водной пленки вокруг частиц почвы могла бы подавляют их функцию в почве. Следовательно, они обычно сокращаются или отсутствует в почвах разновидность. Однако они не всегда присутствуют у пресноводных видов. Пресноводные виды без щетинок, такие как Dorylaimida, Mononchida и Rhabditida, тесно связаны с почвенными видами
II) Большие амфиды. Органы хеморецепторов, такие как амфиды, выполняют иную роль в почвенный раствор, богатый солями и растворенными органическими веществами, и где химическая информация распространяется на очень короткие расстояния.В открытой пресной воде, обычно менее богат растворенными веществами, химический сигнал распространяется долго расстояния и довольно быстро. Уровень сигнала медленно меняется в почве, но быстрее растворяется в открытой воде. Виды почвы и пресноводные виды относящиеся к почвенным видам, обычно имеют мелкие, иногда точечные амфиды.
iii) Ocelli. Световые рецепторы довольно часто встречается у морских нематод, но редко встречается у пресноводных видов.В почвенные виды, они вообще отсутствуют
iv) Хвостовые железы и фильера . Железы, выделяющие липкую вещества через фильеру для закрепления кончика хвоста полезно для нематод, живущих на поверхности осадка, чтобы избежать влияние водных течений. Не у всех водных видов есть хвостовые железы и фильера,
Анализ сообществ нематод в водной среде показывает, что заболеваемость и преобладание видов в сообществе отражают характер и качество окружающей среды.Неудивительно, что типы присутствующих видов (и результирующая структура сообщества) различаются в морской, солоноватой и пресноводной среде. Недавние наблюдения показывают, что разные виды нематод по-разному реагируют на ухудшение качества окружающей среды. Таким образом, степень и характер изменений в структуре сообщества водных нематод могут быть отличным индикатором качества воды или уровней загрязнителей.
Нематоды в пресноводных водных системах также служат источником питательных веществ для беспозвоночных, мелких позвоночных и грибов.Источником пищи для этих нематод являются в первую очередь бактерии, но также потребляются водоросли и грибы. Значительное количество нематод, паразитирующих на растениях, в водных системах связано с высшими растениями, хотя влияние их паразитизма на эти растения, как правило, неизвестно. Предварительные исследования указывают на возможность борьбы с этими нематодами при биологической борьбе с водными сорняками (Gerber and Smart, 1987). Роды, паразитирующие на сельскохозяйственных культурах, выращиваемых в погруженной культуре (например,g., рис) хорошо охарактеризованы и являются чрезвычайно серьезными вредителями сельскохозяйственных культур во всем мире.
Морская среда обеспечивает среду обитания для огромного разнообразия нематод с поверхности, литорали и устья зоны в глубины океана.Одна интересная группа глубоководных нематод: Rhaptothyridae, у которых нет рта и очень сильно сокращен пищеварительный тракт. Пищеварительный тракт наполнен симбиотическими хемоаотрофными бактериями. А аналогичные отношения существуют в роду безротовых Astomonema . А Проект Дарвиновской инициативы между 199 и 2002 гг. Биоразнообразие нематод и глобальное загрязнение Мониторинг.
Нематоды обычно составляют 70–90% мейобентосных многоклеточных, населяющих отложения морских днища.На 0,25 м 2 морского дна их плотность может быть> 10 6 частные лица. (Мокиевский и др. 2004, 2007). Около 4000–5000 видов были описаны морские нематоды, и многие другие обнаружены и описаны от текущих морских геологоразведочных проектов. Описано большинство видов из относительно доступных мелководий, но должны или только 9% мирового океана; 91% дна океана находится в «глубоких» море », и исследования, проведенные к настоящему времени, сообщили о более чем 600 видах на глубинах с глубины 400-8350 метров (Милютин и др., 2010). Ясно, что есть огромный объем океана еще предстоит исследовать.
Нематоды в городской среде
Мы только начали понимать природу проблем нематод и биологию нематод в городской среде.По мере изменения демографии, экономики и моделей землепользования в штате исследования в области городской нематологии будут приобретать все большее значение. В рамках городской нематологии можно выделить индивидуальный, социальный и коммерческий компоненты.
Люди создают личную среду, включающую деревья, кустарники, другие однолетние и многолетние декоративные растения, почвопокровные растения, газоны, комнатные растения и огороды.Часто растения помещают непосредственно в почву, уже содержащую нематод, паразитирующих на растениях, из предыдущей посадки; нематоды также могут быть занесены при текущих посадках в соответствующую почву и корни. Очевидно, что планировка и виды растений, используемых в городском садоводстве, не выбраны из-за несовместимости с соответствующими видами нематод. Нематоды
интродуцированный или поддерживаемый одним видом растений может быть очень вредным для соседних или сопутствующих растений.Такие отдельные растения имеют эстетическую ценность или вызывают эмоциональные привязанности и, следовательно, имеют высокую индивидуальную ценность. Повреждение нематодами газонов и почвенного покрова часто приводит к плохому росту, голым пятнам и появлению хлоротиков, которые человек пытается исправить, увеличивая количество удобрений и воды.
Социальные компоненты городской нематологии включают эффекты нематод в парках, зонах отдыха, ландшафтных насаждениях, шоссе, школах и т. Д.Проблемы дерна, связанные с нематодами, вызывают беспокойство в индустрии отдыха и ландшафта. Опять же, все эти посадки имеют огромную ценность с точки зрения руководства и общественного мнения. Повреждение и отсутствие роста растений из-за паразитизма нематод приводят к неприглядному виду.
площади, усиление конкуренции с сорняками и увеличение использования воды и удобрений. Коммерческие компоненты городской нематологии включают затраты на борьбу с нематодами — или отсутствие борьбы с нематодами — производителями растений в питомниках, дерновых фермах и теплицах.Экономика городской нематологии также включает деятельность агрохимических предприятий, оптовиков, розничных торговцев, консультантов и консультантов.
Как и в других областях нематологии, мы должны учитывать положительные и отрицательные аспекты нематод в городской среде. Нематоды могут действовать в первую очередь как вредители или патогены, а также могут участвовать в пищевых цепочках разложения, используя мертвые организмы в качестве источников углерода и энергии.Часто наиболее продуктивные почвы содержат большие популяции непаразитических нематод, участвующих в круговороте минералов и питательных веществ. Фактически, высокий уровень популяции таких нематод может быть индикатором продуктивных почв со здоровым биологическим статусом.
По мере того, как знания о проблемах нематод в городских условиях возрастают, возрастает и потенциал для разработки пространственных структур и последовательностей садов на заднем дворе, чтобы обеспечить максимальные возможности управления нематодами.Последовательности посадки и сопутствующие посадки могут быть выбраны с учетом чувствительности к нематодам или даже аллелопатических эффектов. Повышение биологической активности почвы для улучшения состояния питательных веществ и влажности, так как а также биологический антагонизм нематод, может быть достигнута с минимальными затратами за счет интенсивных усилий заядлых садоводов на небольших территориях. Сад на заднем дворе дает возможность создать микрокосмическую ситуацию «устойчивого сельского хозяйства». Это среда, которой домовладелец может контролировать и манипулировать экспериментально, не беспокоясь о товарности или прибыльности сельскохозяйственных культур.Эксперименты с манипуляциями с почвой, включением органического вещества, сопутствующих растений, последовательностей и пространственных структур растений могут быть богатым источником инноваций и дать важные биологические открытия. Могут быть введены и протестированы биологические антагонисты нематод; полезные нематоды для биологической борьбы с насекомыми-вредителями также могут быть введены и сохранены в системе. Возможности для наблюдения, формулирования и проверки гипотез легче предоставляются садом на заднем дворе, чем коммерческим сельским хозяйством.Чтобы извлечь выгоду из этих возможностей, необходимо решить многие исследовательские вопросы; они включают совместимость видов растений (с точки зрения статуса хозяина или воздействия на различные виды нематод) и знание нематод, присутствующих на данном участке, и их вирулентности на декоративных растениях. Возможно, для отраслей, влияющих на городскую нематологию, может потребоваться усиленное регулирование, чтобы свести к минимуму количество нематод. интродукции и распространение в городской среде.
Ссылки:
Кобб, Н.А. 1914 г. север Американец свободная жизнь пресноводный нематоды.Перепечатано из Пер. Являюсь. Микр. Soc.33 в Кобб, N.A. Взносы к а Наука из Нематология.
Гьер, О. 1995 г. В бактериальный эндосимбиоз из в безжалостный нематода, Astomonema Southwardorum — структурный аспекты. J из Мар. Биол Assoc из в Соединенное Королевство 75: 153-164.
Милютин, Д.М., Гад, ГРАММ., Милютина, М.М., Моклевского, В.О., Гонсека-Женевуаз, В., Эстевес, ЯВЛЯЮСЬ. 2010 г. В штат из знания на глубокое море нематода таксономия: как много действительный разновидность находятся известный вниз там? морской Биоразнообразие 40: 143-159.
Мокиевский VO, Удалов AA, Азовский AI (2004) На в количественный распределение из мейобентос на в полка из в Мир Океан.Океанология 44 (1): 99–109
Мокиевский VO, Удалов AA, Азовский AI (2007) Количественный распределение из мейобентос в глубокая вода зоны из в Мир Океан.Океанология 47 (6): 797–813.
Платт, ЧАС. М.1994, Предисловие. В В Филогенетический Систематика из Свободная жизнь Нематоды, С.Лоренцен, изд., pp.i-ii, В Луч Общество, Лондон.383п.
Warwick RM, Platt HM, Somerfield PJ (1998) Свободный морской пехотинец нематоды. Часть III. Монгистериды. Краткие обзоры британской фауны (новая серия) Нет.53. Совет полевых исследований, Шрусбери, Великобритания. 296pp.
Зуллини, А. а также Семпруччи, Ф. 2019. Морфологический различия между свободная жизнь почва а также пресная вода нематоды в связь к их среды.Нематология 22: 125-132.
Нематоды — это круглые черви, принадлежащие этому месту
В следующий раз, когда вы обнаружите, что превращаетесь в комаров, вспомните это видео:
Это Strelkovimermis spiculatis — паразитическая нематода, или круглые черви, ускользающие от насекомых. от незадачливой личинки комара, срок годности которой скоро истечет.То, как эта личинка дергается, когда нематода вылезает наружу, мучительно. Вы все еще можете видеть, как жизненно важные органы бедной личинки перекачиваются даже после того, как нематода эвакуируется, а разорванная кутикула личинки разрывается, обрекая ее на смерть. Похоже, что зараженные нематодами личинки комаров в конце концов получают дополнительный микровкус опыта ацтекских человеческих жертвоприношений.
Вы можете думать, что планета принадлежит людям. Вы ошиблись. Черви, подобные изображенному на этом видео, — повелители животных Земли; нематоды — самые многочисленные животные на Земле.Их не просто ничтожное большинство. Четыре из пяти животных на Земле — нематоды.
Натан Август Кобб, нематолог, работающий в Министерстве сельского хозяйства США, в 1915 году сказал об этом так:
Короче говоря, если бы все вещество во Вселенной, кроме нематод, было сметено, наш мир все равно был бы смутно узнаваемым. , и если бы мы, как бестелесные духи, могли затем исследовать его, мы бы обнаружили его горы, холмы, долины, реки, озера и океаны, представленные пленкой нематод.Местоположение городов можно было бы расшифровать, поскольку для каждого скопления людей будет соответствующее скопление определенных нематод. Деревья по-прежнему стояли бы призрачными рядами, представляя наши улицы и шоссе. Местоположение различных растений и животных все еще можно было бы расшифровать, и, если бы мы имели достаточные знания, во многих случаях даже их вид можно было бы определить путем изучения их бывших паразитов нематод.
Ни один организм на Земле не освобожден. Согласно Колину Таджу в «Разнообразии жизни», было высказано предположение, что у одного из каждых двух видов животных на Земле есть по крайней мере один вид паразитических нематод, которые живут с ним только .Приведу лишь один пример: вот яркое изображение Алексом Уайлдом наполненного нематодами муравья из Белиза. «Я не могу себе представить, что должно чувствовать насекомое, зараженное мермитидной нематодой», — пишет он. «В масштабе человека мермитид будет по крайней мере столь же навязчивым, как анаконда, свернувшаяся в кишечнике».
На другом конце спектра самая большая известная нематода — Placentonema gigantissima , которая может достигать 30 футов в длину в плаценте своего хозяина, кашалота. Мне удалось найти предполагаемую фотографию этого зверя; Мне особенно нравится четвертый пункт в подписи.И мне интересно: как эта нематода передается от хозяина к хозяину? Конечно, кашалоты не похожи на собак, если вы понимаете, о чем я, и им совершенно не нужно беспокоиться о мытье рук.
В мире растений нематоды с корневыми узелками проникают в корни и выделяют химические вещества, которые раздувают корни опухолями, истощая наземные силы растения. В основе этих опухолей самки нематод высасывают сок из гротескных многоядерных «гигантских клеток». Они толстеют от этого богатого корма, раздуваясь, в свою очередь, в свои гротескные воздушные шары, прежде чем выдавить слизистую массу яиц со своих огромных задников.Их влияние на нас немалое; По оценкам Американского фитопатологического общества, нематоды, являющиеся патогенными для растений, ответственны за 14% потерь урожая во всем мире.
Ближе к дому нематодные болезни, такие как анкилостомы, речная слепота и слоновость, поражают людей, в то время как «черви» являются основными паразитами кошек и собак. Рассмотрим недавнюю шокирующую новость о том, что каждые два дня собаки из Бристоля, Великобритания, производят в своих 8 тоннах фекалий популяцию яиц круглых червей, которые легко предотвратить, затравив собак, что эквивалентно количеству людей на Земле (это 7 миллиарда, для тех, кто следит дома).Эти черви могут вызвать слепоту у людей, которые случайно проглотят их после работы с грязью. Плохие хозяева. ПЛОХОЙ.
Toxocara canis, собачий аскарид. Я бы действительно предпочел не думать о том, что было сделано при создании этой фотографии. Creative Commons Джоэл Миллс. Щелкните для лицензии и источника.
Не все нематоды являются паразитами. Некоторые работают, чтобы заработать себе хлеб насущный, как и все мы, собирая пищу в воде или почве. Есть хищные нематоды, которые используют свои пронзающие стилеты для нападения и пожирания простейших или других микробов.Вот хищная нематода Pristionchus pacificus , которая пронзает и высасывает жизнь из нематоды лабораторных крыс Caenorhabditis elegans . Вы можете увидеть глотки жизненно важных жидкостей C. elegans, ритмично текущих в пищевод P. pacificus *.
Другие нематоды — сапрофиты, питающиеся любыми лакомствами, которые они могут съесть. Вода, почва, растения и грибы им не подходят.Гнилые яблоки кишат нематодами десятками тысяч. Этот автор был несколько встревожен в лаборатории биологии колледжа, когда обнаружил одну дерзкую нематоду, болтающуюся на в остальном восхитительно выглядевшем дольке яблока, рассматриваемом под микроскопом. «Мы непреднамеренно едим и пьем огромное количество круглых червей в течение нашей жизни», — объясняет мой учебник по биологии в колледже услужливо, хотя и вызывает тошноту.
Почвы и отложения особенно богаты нематодами. Они составляют 90% всех форм жизни в океанических отложениях.В почве так много нематод, что целые группы грибов посвятили себя отлову и питанию ими, как объясняет здесь Дэвид Аттенборо:
Аттенборо не упоминает об этом, но в дополнение к знаменитая надувная петля, грибы создали множество ловушек и ловушек для нематод. Некоторые спортивные липкие ловушки; другие плести сети.
Что касается героя (злодея?) Нашего первого видео, поскольку Strelkovimermis атакует широкий спектр видов комаров, ученые, по понятным причинам, проявили интерес к нему как к потенциальному агенту биоконтроля.Болезни, передаваемые комарами, убивают человек, поэтому умение убивать этого маленького червяка может спасти жизнь многих бедных людей.
Яйца S. spiculatus могут оставаться в состоянии покоя и даже обезвоживаться в течение нескольких месяцев. Но за вылупление в неподходящее время приходится дорого обходиться: если только что вылупившиеся личинки не смогут найти свой собственный дом от комаров в течение 24-48 часов, они умрут. Ученые из Центра биологии переносчиков при Университете Рутгерса предположили, что яйца должны очень точно определять, есть ли поблизости личинки комаров.Но что же такого в личинках комаров, спросили они, что стимулирует вылупление яиц Strelkovimermis ?
Это запах личинки комара? Или то, как они извиваются?
Итак, они подвергли яйца Strelkovimermis воздействию воды, ранее подвергавшейся воздействию личинок комаров и того, что они очаровательно называли «искусственными личинками». Перевод: трехмиллиметровый кусок железной проволоки, покрытой горячим клеем, бросили в воду и уговорили танцевать не с помощью Smith & Wesson, а с помощью обычной магнитной мешалки.
Они обнаружили, что, хотя запах личинок довольно хорошо стимулирует вылупление яиц (33% вылупившихся в воде, подвергшейся воздействию личинок, против 12% в простой контрольной воде), искусственные личинки сами по себе малоэффективны (вылупившиеся 17%). Но добавление ароматной личинки воды с извивающимся искусственным комаром усилило эффект одного запаха и заставило более половины — около 60% — яиц вылупиться. Лучше всего, конечно, действовали настоящие личинки комаров, но лишь немного лучше, чем имитация: около 73% из них вылупились.Это довольно впечатляющий подвиг для комбинации воды с личинкой и нескольких секунд с горячим клеевым пистолетом.
Интересно, что авторы пришли к выводу, что нынешняя стратегия выпуска молодых нематод в поисках хозяина для борьбы с комарами оправдана во временных бассейнах, где комары размножаются только тогда, когда они заполнены. Но в отношении прудов или других постоянных водоемов они посчитали, что нынешняя стратегия неверна. Поскольку молодые особи живут всего день или два и умрут, если им не удастся найти хозяина, в то время как спящие яйца могут выживать месяцами и осуществлять «наблюдение» за хозяином без какой-либо нашей помощи, они пришли к выводу, что выпускать на волю гораздо больше. спящие яйца, взрослые особи или даже предварительно инфицированные личинки комаров.Практически все, что угодно, , но инфекционных молодых особей. Вперед, наука!
Какими бы ни были их методы работы, нематоды, такие как Strelkovimermis , живут повсюду на Земле, о которых вы только можете себе представить. Им даже рок не властен. Нематод вылавливали из щелей золотых приисков Южной Африки глубиной почти две мили. По словам ученого Министерства сельского хозяйства США Кобба, один вид нематод был описан исключительно на войлочных немецких пивных подставках.
Поскольку у нематод нет крыльев, можно предположить, что есть только одно убежище: небо.
____________________________________________
* Как отмечает автор видео, P. pacificus обладает тем же количеством и конфигурацией нервных клеток, что и C. elegans . Тем не менее, он обладает хищным поведением, а C. elegans — нет. Автор встроенного видео интересуется, почему это может быть.
Спасибо хорошим ребятам из блога Parasite of the Day за пост, который вдохновил его.
Как отмечает автор видеозаметки, п.pacificus имеет такое же количество и конфигурацию нервных клеток, что и C. elegans . Тем не менее, он обладает хищным поведением, а C. elegans — нет. Автор видео интересуется, почему это может быть. Помните, что это организмы, которые являются животными, но не имеют «мозга»
Биология нематод и управление ими в кукурузе
Нематоды похожи на сорняки и насекомые-вредители кукурузы тем, что существует множество видов нематод с различными биологическими характеристиками, которые способны снижать урожай кукурузы.Различная почвенная среда благоприятствует разным видам нематод.
Трудно установить широко применимые экономические пороговые значения для популяций нематод, учитывая их тенденцию к неоднородному распространению и другие факторы стресса, которые могут повлиять на снижение урожайности. Экономические пороги, установленные университетами, могут сильно различаться от штата к штату. Ученые Corteva Agriscience разработали высокие показатели популяции основных видов кукурузных нематод в качестве относительной меры низкого, среднего или высокого уровня популяции.В основе этих показателей лежат пороговые значения университетов и нематологов, а также результаты исследований Corteva. Цель индикатора высокой популяции — упростить характеристику уровней популяции нематод с учетом различных пороговых значений в разных штатах.
Corteva Agriscience исследовала семь экономически важных видов нематод кукурузы. Эти семь видов считаются экономически важными на основании сочетания их распространенности и потенциального травматизма сельскохозяйственных культур.
Жалящие нематоды (
Belonolaimus spp.)- Потенциал повреждения: Очень разрушительный
- Распространенность: Редко в кукурузном поясе, обычен в прибрежных и равнинных штатах
- Тип почвы: Песчаный
- Высокий показатель численности населения: 1 на 100 см 3 почвы
Жалящие нематоды обитают на песчаных равнинах в штатах Атлантического океана и побережья Персидского залива, а также в песчаных районах в штатах Среднего Запада, включая Канзас и Небраску.Это эктопаразиты, которые питаются снаружи корнями, не прикрепляясь к ткани корня и не проникая в нее. Яйца жалящих нематод вылупляются примерно через 5 дней и достигают полной взрослой стадии через 18-28 дней. Они мигрируют вниз по профилю почвы по мере развития корней, повышения температуры почвы и снижения влажности.
Питание происходит на концах и по бокам корней и может привести к опоясыванию и гибели корня. Жалящие нематоды перед кормлением вводят в ткань корня высокотоксичное вещество.Травмированные участки будут выглядеть черными и впалыми. Жалящие нематоды очень большие (около 3 мм) и обитают в почвах с содержанием песка не менее 70%. Однако они могут быть очень опасными, особенно когда присутствуют нематоды с короткими корнями. Сообщалось о серьезных потерях урожая кукурузы более 50%. У жалящих нематод широкий круг хозяев, включая сою и хлопок; таким образом, один только севооборот не обеспечит эффективного управления.
Игольчатые нематоды (
Longidorus spp.)- Потенциал повреждения: Очень разрушительный
- Распространенность: Иногда
- Тип почвы: Песок и суглинистый песок, иногда на более мелких почвах
- Высокий показатель численности населения: 1 на 100 см 3 почвы
Игольчатые нематоды — самый разрушительный тип кукурузных нематод на Среднем Западе, но обычно они обитают на песчаных и суглинистых песчаных почвах из-за их большого размера.Игольчатые нематоды относительно большие, от 3 до 8 мм в длину, и для их размера необходимо большее пространство пор в песчаной почве. Снижение урожайности может быть серьезным, в самых крайних случаях превышающим 60%. Корни кукурузы станут короткими из-за обрезки более мелких корней, а надземная часть растения будет казаться низкорослой, с симптомами, напоминающими стресс от засухи. Игольчатые нематоды мигрируют вниз по мере развития корней, повышения температуры почвы и снижения влажности. Игольчатые нематоды питаются в основном видами трав, поэтому севооборот с соей или другой культурой, не являющейся травой, может быть эффективным инструментом управления.
Копьевые нематоды (
Hoplolaimus spp.)- Потенциальный урон: Умеренный
- Распространенность: Иногда
- Тип почвы: Много типов почвы, зависит от вида
- Высокий показатель численности населения: 50 на 100 см 3 почвы
Нематоды Lance также потенциально опасны. Как и игольчатые нематоды, они относительно большие (около 1,5 мм), что делает песчаные почвы их наиболее подходящей средой обитания.Однако они не ограничиваются песчаными почвами и могут быть найдены в широком диапазоне типов почв. Пиковые нематоды имеют широкий круг хозяев, что может ограничивать эффективность севооборота как средства борьбы. Известно, что по крайней мере четыре вида Hoplolaimus влияют на кукурузу. H. galeatus распространен на всей территории США и является наиболее распространенной ланцетной нематодой на кукурузных полях Среднего Запада.
H. columbus , широко известная как колумбийская нематода, обычна в южных штатах, где она также может быть вредным организмом для сои и хлопка.
H. galeatus может существовать в различных типах почв, тогда как H. columbus гораздо более ограничен песчаной почвой. Ланцовые нематоды изначально являются эктопаразитами, но могут частично или полностью проникать в ткань корня. Ланцовые нематоды вызывают задержку роста кукурузы в начале сезона, что приводит к появлению веретенообразных растений с пониженной урожайностью при сборе урожая.
Корневая система кукурузы серьезно повреждена при кормлении нематодами. Экссудат корней из-за сильного кормления приведет к прилипанию почвы к корням, как показано здесь.Фото любезно предоставлено Джимом Лафренцем.
Короткокорневые нематоды (
Paratrichodorus minor )- Потенциальный урон: Умеренный
- Распространенность: Обычный
- Тип почвы: Много типов
- Высокий показатель численности населения: 50 на 100 см 3 почвы
Нематоды с короткими корнями распространены в кукурузе в США на самых разных почвах. Короткокорневые нематоды — это эктопаразиты, которые питаются кончиками корней, что приводит к образованию коротких, коротких корней, которые могут напоминать повреждение гербицидом.Пораженные растения будут низкорослыми, желтыми и могут показывать дефицит магния. Кукуруза является предпочтительным хозяином нематод с короткими корнями; однако у них есть широкий спектр хозяев, включая многие другие виды сельскохозяйственных культур, такие как хлопок, соя и подсолнечник.
Нематоды с корневыми узлами (
Meloidogyne spp.)- Возможный урон: Урон при большом количестве населения
- Распространенность: Обычный
- Тип почвы: Много типов
- Высокий показатель численности населения: 50 на 100 см 3 почвы
Нематоды с корневыми узелками — это малоподвижные эндопаразиты, которые проводят большую часть своего жизненного цикла в тканях корня.Там они образуют на корнях небольшие галлы. Множественные виды узловатых нематод поражают различные диапазоны сельскохозяйственных культур по всей Северной Америке, поэтому для эффективного управления необходимо знать конкретные присутствующие виды. Из четырех наиболее распространенных видов кукуруза является хозяином для трех. У корневых нематод обычно широкий круг хозяев, что ограничивает эффективность севооборота как средства борьбы с ними. Люцерна и овес не являются культурами-хозяевами, которые можно чередовать с кукурузой для сокращения популяций; однако соя является культурой-хозяином и может быть повреждена даже больше, чем кукуруза, особенно в южной части США.S. Южная узловатая нематода (M. incognita) является серьезным вредителем хлопка, и севооборот с кукурузой может увеличить вероятность потери урожая хлопка. Исследования показали устойчивость у некоторых инбредов и гибридов кукурузы, однако большинство современных гибридов не устойчивы к нематодам, вызывающим завязку корневых узлов.
Кинжальные нематоды (
Xiphinema spp.)- Потенциальный урон: Умеренный
- Распространенность: Иногда
- Тип почвы: Много типов
- Высокий показатель численности населения: 50 на 100 см 3 почвы
Кинжальные нематоды — еще один относительно крупный тип нематод, поэтому их предпочитают песчаные почвы, но не ограничиваются ими.Кинжальные нематоды имеют широкий спектр хозяев и являются важными вредителями многих других культур, в первую очередь винограда и других фруктов. Известно, что один вид, X. americanum, имеет очень долгий жизненный цикл. Этот вид размножается один раз в год и может жить от 4 до 5 лет в ненарушенной почве с благоприятными условиями. Севооборот не является эффективным средством борьбы с кинжальными нематодами; однако обработка почвы может нарушить их жизненный цикл и помочь сократить численность популяции. Поедание корней кукурузы кинжальными нематодами может вызвать задержку роста и хлороз.Помимо повреждения корней нематоды Dagger могут переносить вирусную мозаику и болезни увядания.
Пораженные нематоды (
Pratylenchus spp.)- Потенциальный урон: Умеренный
- Распространенность: Очень часто
- Тип грунта: Все типы
- Высокий показатель численности: 150 на 100 см 3 почвы
Несмотря на то, что нематоды не являются наиболее опасным типом нематод, они считаются наиболее важным родом для выращивания кукурузы на Среднем Западе из-за их распространенности.Поражающие нематоды широко распространены, и плотность популяции 10 000 нематод / см 3 почвы не является редкостью. Этот род встречается в широком диапазоне типов почв. Есть шесть видов этого рода, которые, как известно, питаются кукурузой. Пораженные нематоды — это мигрирующие эндопаразиты, которые попеременно питаются и перемещаются в ткани корня.
